sodio
- 1. Kim.
Zenbaki atomikoa 11 duen elementu kimikoa. Metal alkalinoa, zuria eta biguna da. Oso erreaktiboa da; bortizki erreakzionatzen du urarekin, hidrogenoa askatuz. Naturan gatz arruntaren forman dago nagusiki, eta silikato askoren osagaia ere bada. Prozesu industrial askotan erabiltzen da, hala nola argi horia ematen duten sodio-lurrunezko deskarga-lanparen fabrikazioan, erreaktore nuklearretan (likido hoztaile gisa), aleazioetan, erreakzio organikoetan (katalizatzaile gisa) eta zelula fotoelektrikoen fabrikazioan. Bizirako funtsezko elementua da (adibidez, zelulaz kanpoko likidoko katioi ez-organiko nagusia da).

- 1. Kim.
- Zenbaki atomikoa 11 duen elementu kimikoa. Metal alkalinoa, zuria eta biguna da. Oso erreaktiboa da; bortizki erreakzionatzen du urarekin, hidrogenoa askatuz. Naturan gatz arruntaren forman dago nagusiki, eta silikato askoren osagaia ere bada. Prozesu industrial askotan erabiltzen da, hala nola argi horia ematen duten sodio-lurrunezko deskarga-lanparen fabrikazioan, erreaktore nuklearretan (likido hoztaile gisa), aleazioetan, erreakzio organikoetan (katalizatzaile gisa) eta zelula fotoelektrikoen fabrikazioan. Bizirako funtsezko elementua da (adibidez, zelulaz kanpoko likidoko katioi ez-organiko nagusia da).
Sodioa Edit
Egilea: Aintzane Goñi
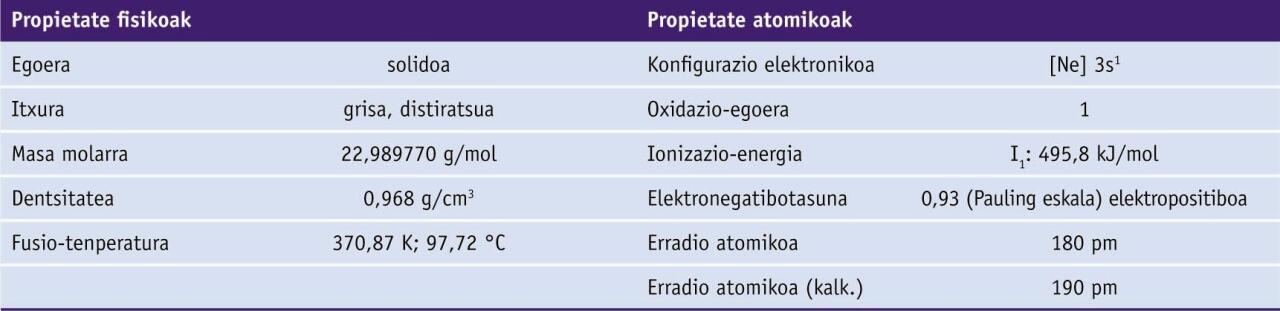
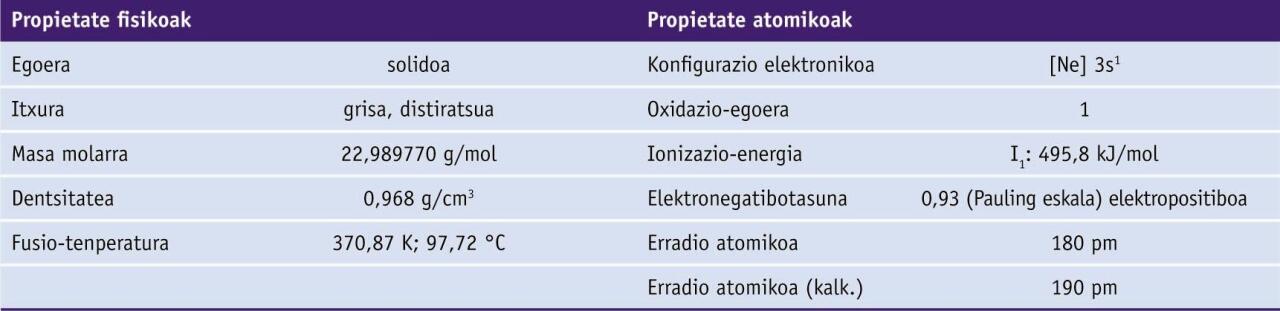
Taula periodikoan, 11. elementua da, 1 taldeko metal alkalinoa. Bere ikurra Na da, latinezko natrium izenaren laburdura. Sodioaren zenbait konposatu antzinatik ezagunak izan arren, Sir Humphry Davyk 1807an lortu zuen lehen aldiz elementua egoera metalikoan.
Propietate fisiko eta kimikoak
Sodio metalikoa solido gris, distiratsu eta biguna da. Eroankortasun elektriko eta termiko handiak ditu.
Sodioaren zenbait propietate
Elementu alkalino guztiek bezala, sodioak erraz galtzen du bere balentzia-elektroi bakarra, ionizazio-energia txikia eta erredukzio-potentzial negatiboa dituelako.
Ugaritasuna eta produkzioa
Lurrazalean, sodioaren portzentajea % 2,6 da pisuari dagokionez, baina ez da elementu gisa azaltzen. Naturan, sodio kloruro moduan ageri da gehienbat, bai itsasoko uretan disolbatuta, bai halita mineral eran. Sodio karbonatoa (trona izenekoa), sodio nitratoa (Txileko nitratoa) eta beste hainbat mineral gisa ere aurki daiteke (gatz).
Metal alkalinoen artean, industria-eskakizun zabalena duena da. Sodio metalikoa urtutako NaCl-tik lortzen da elektrolisiaren bidez, Down-cell prozesuan. Oso elementu erreaktiboa denez, Ti, Zr, Hf eta beste zenbait metal eskuratzeko erreduktore gisa erabiltzen da.
TiCl4 + 4 Na → Ti + 4 NaCl
Sodioa kanpoaldeko argiztapenerako lurrun-lanparetan ere erabiltzen da, bere 3p1-3s1 trantsizio elektronikoak argi horia sortzen baitu eta lanpara bakoitzak metalaren miligramo gutxi batzuk baino ez baititu erabiltzen. Piroteknian ere kolore horiak sortzen ditu.
Konposatuak
Sodioaren konposatu gehienak solido ionikoak dira, izaera kobalente txikia dute, kolorgeak dira, eta uretan disolbagarriak. Konposatu nagusiena NaCl-a da, gatz arrunta, alegia. Produktu kimiko garrantzitsuenen zerrendan ez da ageri lehengaia delako. Erabileren artean, hauek azpimarra daitezke: elikagaiak kontserbatzea, errepideetan izotza sortzea galaraztea, ura biguntzeko erretxinak lehenera ekartzea… Industrian, produktu kimiko askoren iturri da, hala nola hauena: Na(s), Cl2 (g) eta NaOH(aq).
Soda kaustikoa (NaOH) NaCl-aren elektrolisiaren bidez lortzen da:
2 NaCl + 2 H2O → 2 NaOH + H2 + Cl2
Konposatu hau delikueszentea eta erregarria da, azalarekin kontaktuan proteinekin erreakzionatzen baitu eta gainazala suntsitzen. Base sendoa da. Xaboi eta detergenteen industrian erabiltzen da, gantz-azidoak neutralizatzeko eta sodio palmitatoa (CH3-(CH2)14-CO-O- Na+) eta antzeko osagaiak ekoizteko. Oro har, Na+ katioia duten xaboiak gogorrak izaten dira; aldiz, K+ dutenak, bigunak.
Soda-errautsa (Na2CO3) beiragintzan erabiltzen da. Trona (Na2CO3 ·NaHCO3 ·nH2O) mineraletik dator, baina luzaroan Solvay (1863) prozesuaren bidez ekoitzi izan da, NaCl, CaCO3 eta NH3 erreaktiboetatik abiatuta. Prozesu industrial horretan, baliabideen ustiapen egokia lortzen zen zenbait lehengai birziklatzean. Sodio bikarbonatoa (NaHCO3) elikagaigintzan eta hauts lehorrezko su-itzalgailuetan erabiltzen da.
Papergintzan, NaCl-aren beste deribatu bat baliatzen da: Na2SO4. Sodio sulfatoak egurraren lignina disolbatzen du, eta zelulosaren zuntzak askatzen ditu.
Na metalikoa, oxigeno ugari dagoenean, Na2O2 peroxido bilakatzen da. Produktu hori zuritzailea eta oxidatzailea da. Bestalde, itsaspeko eta espazio-ontzietako larrialdietarako arnasketa-ekipoetan ere erabiltzen da, erreakzio honen bitartez airea oxigenatzen duelako:
2 Na2O2 (s) + 2 CO2 (g) → 2 Na2CO3 (s) + O2 (g)
Sodio katioia funtsezko osagaia da giza gorputzean. Normalean, 100 g / 70 kg proportzioan egoten da. Potasioarekin batera, burmuinetik abiatzen diren eta burmuinerantz doazen nerbio-bulkaden seinale elektrikoez arduratzen da. Bihotzaren taupada erritmikoen eragile diren seinale elektrikoetan ere parte hartzen du. Giltzurrunetan beharrezkoa da toxinen kanporatze-prozesuetarako.