pila
- 1. Elektron./Fis./Kim./Teknol. Elektr.
- sin. pila voltaiko, pila galvaniko, pila elektrokimiko, zelula elektriko
Erreakzio batean askaturiko energia kimikoa energia elektriko bihurtzen duen gailua.
- 2. Inform.
- 3. Teknol. Elektr.
- sin. pila primario
Deskargatutakoan berriz ezin karga daitekeen pila elektrokimikoa. Erabilienak pila lehorrak dira, hots, elektrolitoak substantzia batek geldiaraziak dituztenak. Gaur egun, zink-magnesio dioxido motako pila da gehien erabiltzen dena (linterna, jostailu, irrati eta abarretan); hiru motatakoak izan daitezke, Leclanchéren pila, zink klorurozko pila eta pila alkalinoa, eta, haien artean, Leclanchéren pila da erabiliena.
- en primary battery, primary cell
- es pila, elemento primario
- fr pile, élément primaire
- 1. Elektron./Fis./Kim./Teknol. Elektr.
- Erreakzio batean askaturiko energia kimikoa energia elektriko bihurtzen duen gailua.
Pila elektrokimikoa Edit
Egilea: Fernando Mijangos
Pila elektrokimikoa (edo pila) bere baitan gertatzen den erreakzio kimiko bati esker elektrizitatea lortzen duen muntaia esperimentala da. Sarri pilak eta bateriak sinonimotzat jo arren, bien artean egon badago diferentzia txiki bat.
Erreakzio kimikoak eta, horietan barne, oxidazio-erredukzio erreakzioak, erredox erreakzioak, itzulgarriak edo itzulezinak izan daitezke. Erreaktiboak soilik produktu bihur daitezkeenean, erreakzioa itzulezina da (produktuak ezin baitira erreaktiboetara itzuli); eta alderantziz, erreaktiboak produktu bihur daitezkeen bezala produktuak erreaktibo bihurtzen badira, erreakzioa itzulgarria da.
Horren kariaz, pila elektrokimikoetan gertatu ohi diren erredox prozesua eta muntaia esperimentala itzulezinak direnez, pilak ezin dira berriz kargatu; agortutakoan zaramara botatzen badira, kutsadura kimiko arriskutsua sortuko dute; pilak metatzeko gordailu berezietara eraman behar dira. Ostera, baterietan gertatzen diren erredox erreakzioak itzulgarriak direnez, neurri handi batean behin eta berriro erabilgarriak izan daitezke, berriz kargatzekoak baitira. Horretan datza, hain zuzen, aipaturiko diferentzia.
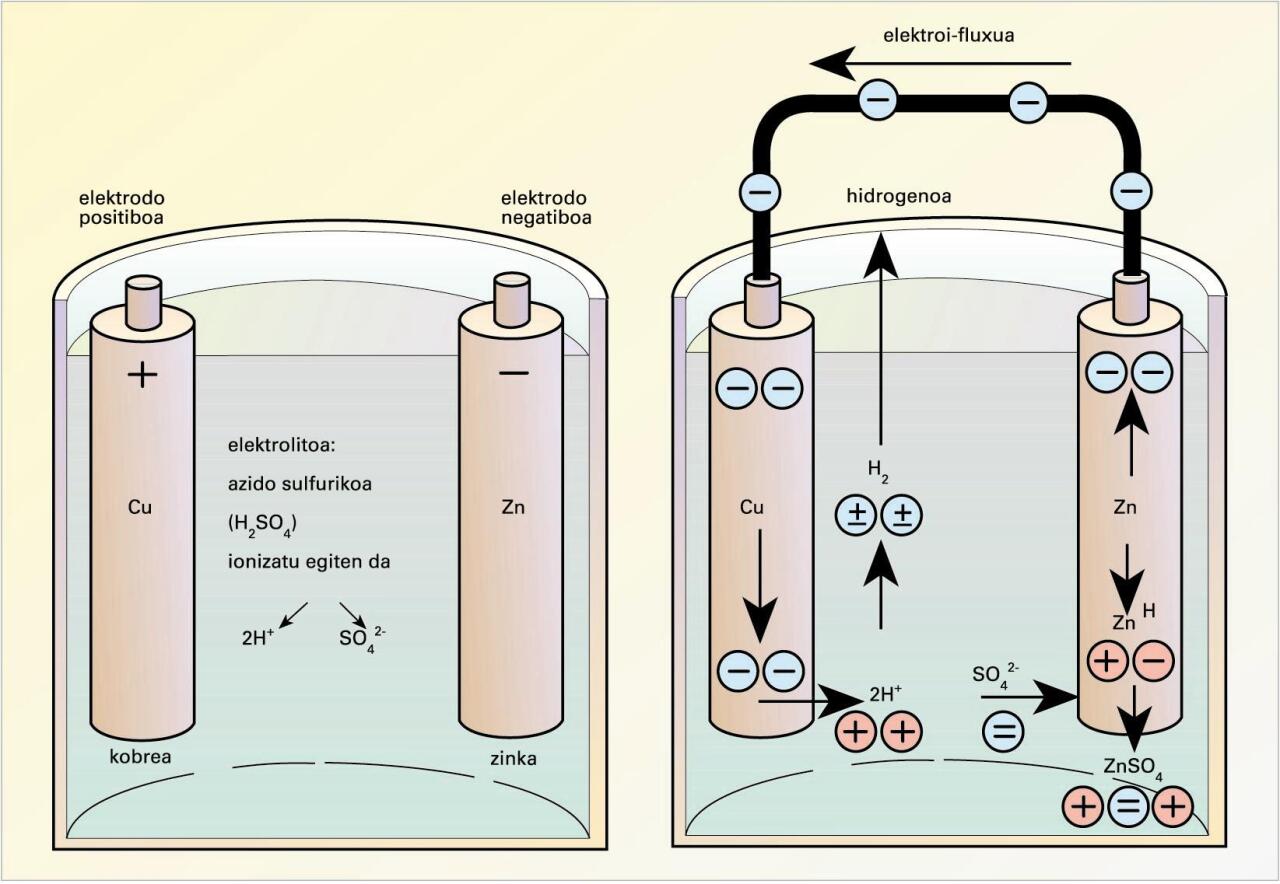
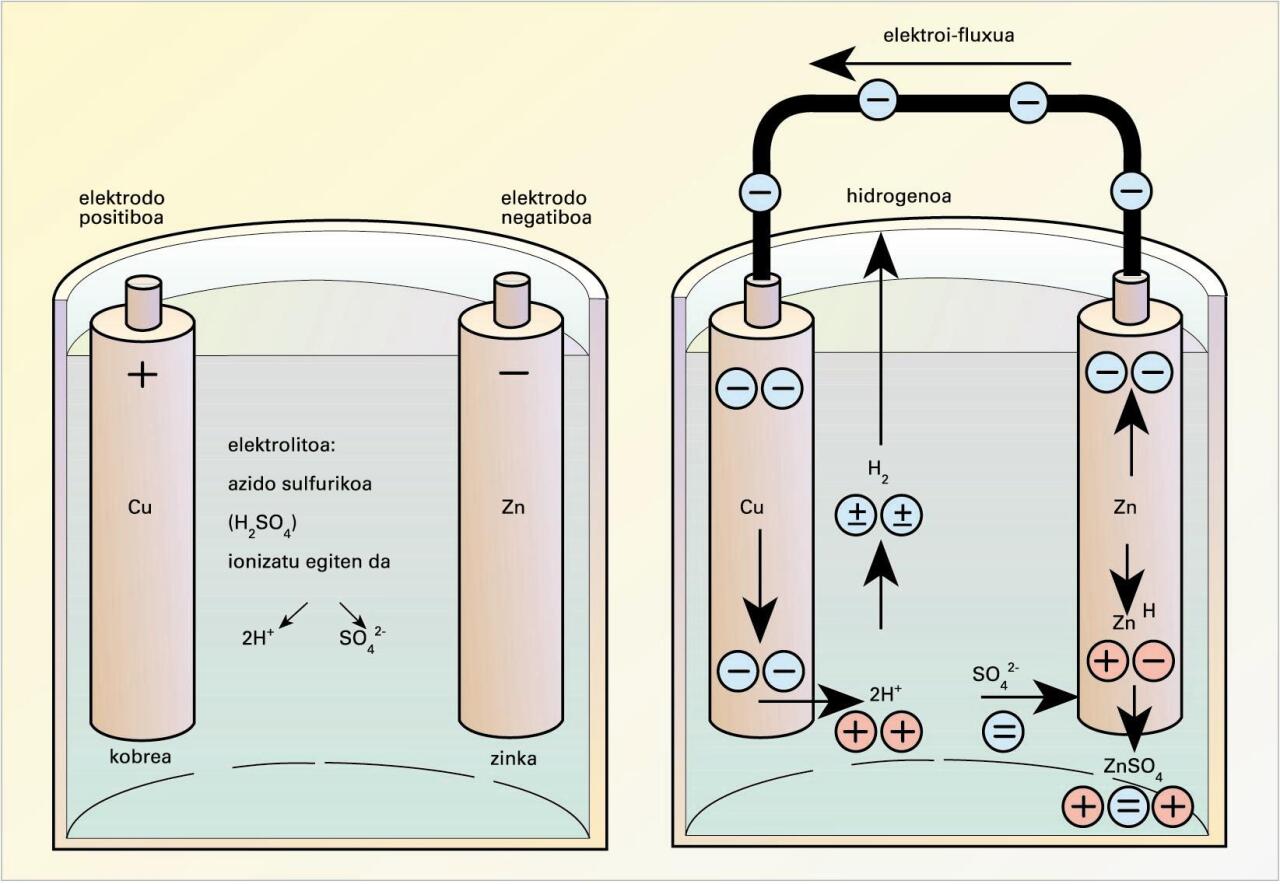
Pila batean gauzatzen den erredox erreakzioa bi erdielementutan banatu behar da muntaia esperimentala egiteko eta, horren bidez, korronte elektriko zuzena lortu ahal izateko, irudi honetan ikus daitekeenez:
Daniellen pilaren eskema (iturria: EVE-EEEren Energiaren Hiztegi Entziklopedikoa)
Katodoan, erredukzioa gertatuko da, esate baterako, Cu2+(aq) + 2e− → Cu0(s), eta anodoan, oxidazioa, esate baterako, Zn0(s) – 2e−→ Zn2+(aq); erreakzioa denetara, Zn(s) + Cu2+(aq) Zn2+(aq) + Cu0(s).
Muntaia esperimentalean, metalak, era banatuan, beren ioien disoluzio ionikoetan murgilduta daude, eta metal biak eroale metaliko baten bidez lotuta. Halaber, disoluzio elektrokimikoek gatz-zubi baten bidez elkarri lotuta egon behar dute, disoluzioetan gerta daitezkeen kargen metaketak ekiditeko eta elektroiek kanpoko zirkuitu elektrikotik bidaiatu ahal izateko.
Esperimentalki neurtutako pilen tentsioak erreakzionatzaileen izaerarekiko, beren kontzentrazioarekiko eta tenperaturarekiko menpekotasuna dauka, Nernstek (1920) proposaturiko ekuazioan ikus daitekeenez:
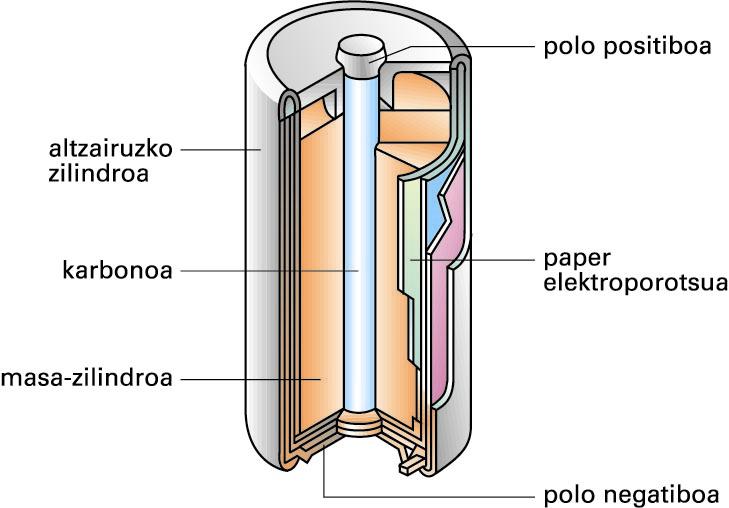
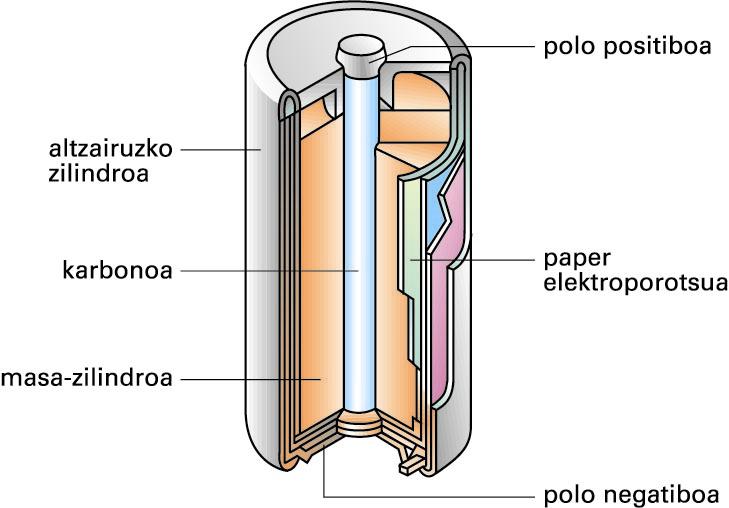
Pila elektrokimiko “busti” horien desabantaila nagusia hau da: likidoak jariakorrak direla eta alde batetik bestera eramateko ez direla batere erosoak. Horregatik, garapen teknologikoa dela medio, antzeko pila lehorrak agertu dira merkatuan; Leclanchéren pila (1868) lehenetarikoa izan zen:
Leclanchéren pila lehorra (iturria: EVE-EEEren Energiaren Hiztegi Entziklopedikoa)
Horren ostean, pila alkalinoak, merkuriozkoak deiturikoak, litiozkoak eta abar merkaturatu dira, eta gaur egun horiek dira gure etxeko tresneriaren jaun eta jabe.
Erregai-pila deritzona etengabe kargatzen ari den pila bat da, erreaktiboak (erregaiak) etengabe hornitzen ari baitira erredox prozesuan, esate baterako, 2 H2(g) + O2(g) H2O(l). Eo = 1,23 V.
Pila horien abantaila nagusia zera da: hidrogenoaren errekuntza dela eta, etekina ia % 100 izan daitekeela; ostera, makina termiko batean, Carnotek etekina mugatzen du, zeina gutxi gorabehera % 33 den. Askoz energia erabilgarri gehiago lortzen da hidrogenoaren errekuntza prozesu elektrokimikoetan gertatzen bada, sugarretan gertatzen bada baino (erregai-pila).