halogeno
- 1. Kim.
- sin. elementu halogeno
Taula periodikoko 17 taldeko elementuetako bakoitza: fluor (F), kloro (Cl), bromo (Br), iodo (I) eta astatoa (At). Halogenoak zuzenean konbinatzen dira metal gehienekin, eta gatzak sortzen dira.
- en halogen, halogen element
- es halógeno, elemento halógeno
- fr halogène
- 1. Kim.
- Taula periodikoko 17 taldeko elementuetako bakoitza: fluor (F), kloro (Cl), bromo (Br), iodo (I) eta astatoa (At). Halogenoak zuzenean konbinatzen dira metal gehienekin, eta gatzak sortzen dira.
Halogenoak Edit
Egilea: Maite Insausti
Halogenoen deribatuak, haluroak hain zuzen, antzinatik ezagutzen diren arren, elementuak orain dela 200 urtetik hona dira ezagunak. Halogeno hitza, halo (“gatza”) eta gen (“sortu”) grekozko hitzetatik dator, eta 17 taldeko elementu ez-metalikoak adierazteko erabiltzen da, hau da, fluor (F), kloro (Cl), bromo (Br), iodo (I) eta astatoa (As) adierazteko. Elementu horien konfigurazio elektronikoa ns2np5 denez, X– anioia eratzeko joera izango dute; horretarako, elektroi bat bereganatzen dute. Oso elementu lurrunkorrak dira, eta molekula diatomikoz osatuta daude (F2, Cl2, Br2, I2).
Fluorra
Gas horia eta korrosiboa da, eta elementurik erreaktiboena, taula periodikoaren elementu guztiekin erreakzionatzen baitu, He, Ne eta Ar-arekin izan ezik. Erreakzionatzeko gaitasun horren ondorioz, ezin da gorde beirazko ontzietan, Si-arekin erreakzionatzen baitu. Gainera, elementu hau berezia da, bere atomoak oso txikiak eta oso elektronegatiboak direlako. Difluor gasa fluorraren gatzen elektrolisiaren bidez lortzen da, HF/KF nahasturatik, hain zuzen. Fluorra fluorazioan erabiltzen da, hots, edateko urari sodio fluoruro kantitate txikiak gehituz hortz-txantxarra prebenitzeko eta, bestalde, politetrafluoroetileno polimeroa, –(CF2-CF2)n–, tefloia egiteko erabili ohi da.
Kloroa
Gas berde-horixka eta oso toxikoa da, eta bi isotopo ditu, 35Cl (% 76ko ugaritasuna) eta 37Cl (% 24koa). Kloro gasa ere oso erreaktiboa da, eta naturan konbinaturik ageri da, kloruroak eta kloratoak eratzen baititu. Laborategian, azido klorhidrikoaren oxidazioaren bidez lortzen da, eta, industria mailan, sodio kloruroaren elektrolisiaren bidez. Kontsumitzen den ura edateko on bihurtzeko, kloroa uretan bertan disolbatzen da (1).
| Cl2 + H2O → 2 H+ + Cl− + ClO− | (1) |
Sortzen diren ClO− hipoklorito ioiek bakterioak suntsitu egiten dituzte oxidazioz. Hipokloritoaren ur-disoluzioari lixiba deritzo. Industrian, kloroa zuritzaile da papergintzan eta ehungintzan. Polimeroak egiteko ere erabiltzen da, adibidez PVCa, polibinil kloruroa, −(CH2−CHCl)n−, edo intsektizida kloratuak ekoizteko, lindanea (hexakloro ziklohexano) adibidez.
Bromoa
Inguruneko tenperaturan likido gorria, lurrunkorra (Pv > 100 mmHg) eta oso dentsoa da. Bi isotopo ditu: 79Br (% 51ko ugaritasuna) eta 81Br (% 49koa). Kloroaren antza kimikoa dauka, baina ez da kloroa bezain erreaktiboa. Elementu hau disolbagarria da disolbatzaile polarretan, hala nola karbono disulfuroan eta karbono tetrakloruroan. Bromoaren ohiko aplikazioa 1,2-dibromoetilenoaren eraketa da, eta berun tetraetiloa duten gasolinetan gehigarri modura erabili ohi den konposatua da. Horrez gain, ura purifikatzeko eta lainoztatzeko produktuak, koloratzaile edo intsektizidak prestatzeko erabil daiteke. Beste aldetik ere, bromoa AgBr eran, argazki-pelikuletan erabiltzen da.
Iodoa
Solido beltza da. I2 diiodo molekula apolarra denez, disolbatzaile polarretan disolbagarria da, eta kolore desberdinak hartzen ditu. Hala ere, ioduroaren disoluzioetan disolbatuta agertzen da, I3− triioduro ioiaren presentziaren ondorioz (2). Iodoa ez da aurreko halogenoak bezain erreaktiboa, eta halogeno elektropositiboena da.
| I2 (s) + I− (aq) ⇔ I3− (aq) | (2) |
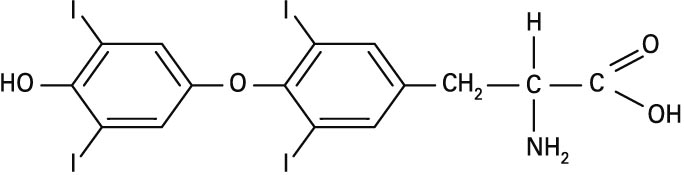
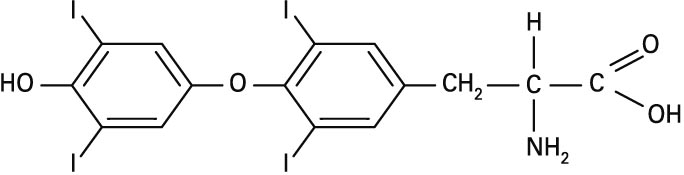
Betadine eta antzeko nahastura iododunak antiseptiko modura erabiltzen dira medikuntzan. Iodoa tiroxinaren osagaia da (ikus irudia), zeina tiroides glandularen hormona den. Eta eguneroko dietan iodo-eskasia izateak tiroides glandularen handitzea dakar, bozio izenez ezagun den gaixotasuna alegia.
Tiroxinaren formula
Astatoa
Elementu erradioaktiboa bismutoa α partikulekin bonbardatzean lortzen da. Astatoak 42 isotopo ditu, eta, euren batez besteko bizitza (t1/2) 8,1 ordu eta 125 ns artean dagoenez, lurrazaleko ugaritasuna oso baxua da. Bere jokaera kimikoa iodoaren antzekoa da.
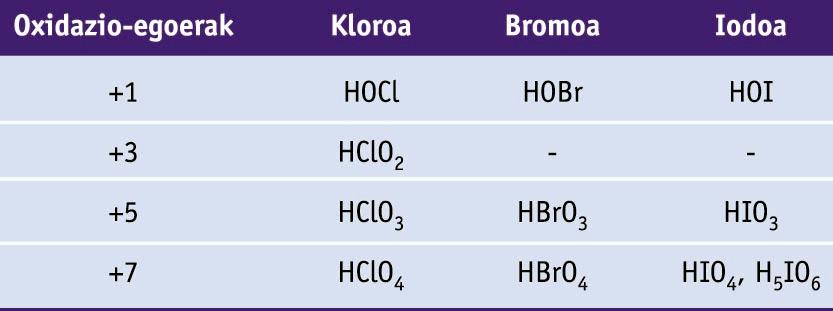
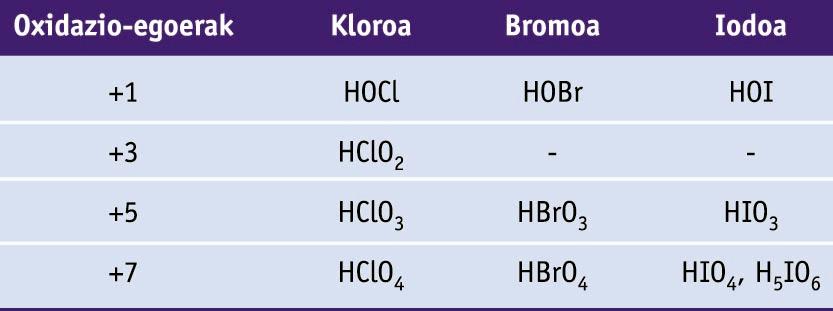
Halogenoen konposatu garrantzitsuenak haluroak eta oxoazidoak dira. Hidrogeno haluroak inguruneko baldintzetan gas kolorgeak eta azido sendoak dira, HF izan ezik. Azido fluorhidrikoa oso erregarria da, eta beirari eraso diezaiokeen substantzia gutxietako bat da. Azido klorhidrikoa, herdoildura kentzeko eta konposatu organokloratuak sintetizatzeko erabiltzen da.
Fluorrak -1 oxidazio-egoera dauka konposatu guztietan. Beste halogenoa guztiek +1, +3, +5 eta +7 oxidazio-egoerak harrapa ditzakete, beraiek baino elektronegatiboagoak diren elementuekin elkartzean. Oxidazio-egoeren ugaritasuna oxoazidoetan aurkitu daiteke.
Halogenoen oxoazidoak (H atomoak O atomoei lotuta daude kasu guztietan)
Kloratoak agente oxidatzaile onak dira, eta klorato solidoak deskonposatzen dira oxigenoa sortzeko. Besteak beste, pospolo eta su artifizialetan erabiltzen dira.