eter
- 1. Fis.
- 2. Kim.
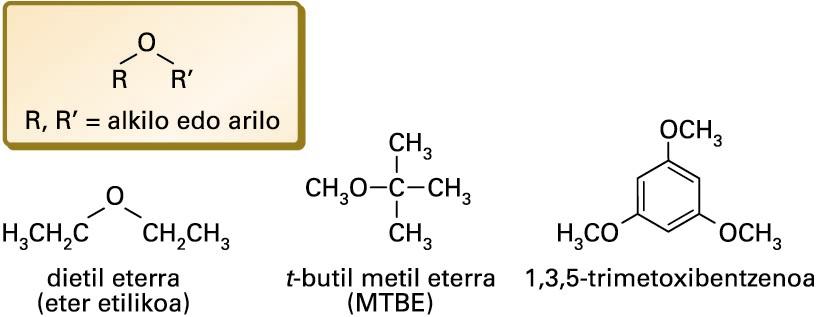
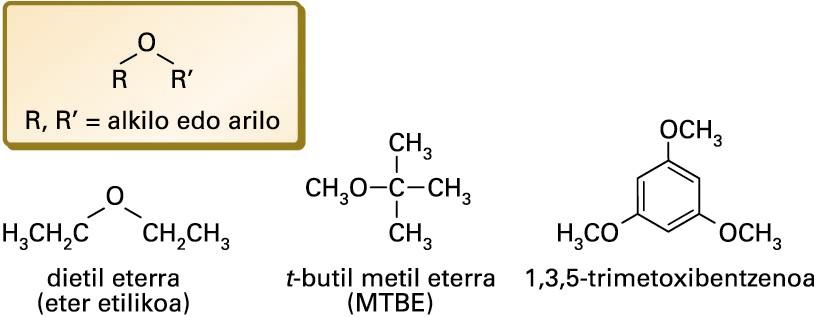
Oxigeno-atomo bati hidrokarburoetatik deribatutako bi erradikal elkartuz osatutako konposatu organikoen izen generikoa (R−O−R').
- 3. Kim.
- sin. dietil eter, eter sulfuriko, etoxietano
(C2H5)2O formulako konposatua. Likido kolorgea eta sukoia. Uretan arinki disolba daiteke, eta alkoholetan disolbagarria da. −116,3 °C-an urtzen da, eta 34,6 °C-an irakiten du. Industrian nahiz sintesi organikoetan disolbatzaile gisa erabiltzen da.
2. Kim.
- 2. Kim.
- Oxigeno-atomo bati hidrokarburoetatik deribatutako bi erradikal elkartuz osatutako konposatu organikoen izen generikoa (R−O−R').
Eterra Edit
Egilea: Eneritz Anakabe, Sonia Arrasate
Eterrak konposatu organikoak dira; substantzia kolorge eta usain berezikoak. Kimikoki, oxigeno atomoari alkilo edo arilo talde bi lotuta dituzten konposatuak dira. Hala, konposatu horien formula orokorra R-O-R’ da, non R eta R’ berdinak (eter simetrikoak) edo ezberdinak (eter ez-simetrikoak) izan daitezkeen. Alkilo talde biak etilo taldeak direnean, anestesiko orokor moduan erabiltzen den eter etilikoa dugu. Konposatu hori XIX. mendean erabiltzen hasi ziren inhalazio bidezko anestesiko gisa. Gaur egun, horren erabilera mugatua dago albo-ondorioengatik (goragalea eta okada eragiten du), eta, anestesiko horren ordez, dinitrogeno monoxidoa (N2O), halotanoa (CF3-CHBrCl) edo enfluorano eter halogenatua (CF2H-O-CF2CHClF) erabiltzen dira.
Konposatu horiek IUPAC sistemari jarraituz izendatzeko, alkilo edo arilo taldeak ordena alfabetikoz izendatzen dira, eta, ondoren, eter hitza jartzen da. Egitura konplexuetan, ─ OR taldea alkoxi taldea izango balitz moduan izendatzen da.
Zenbait eter
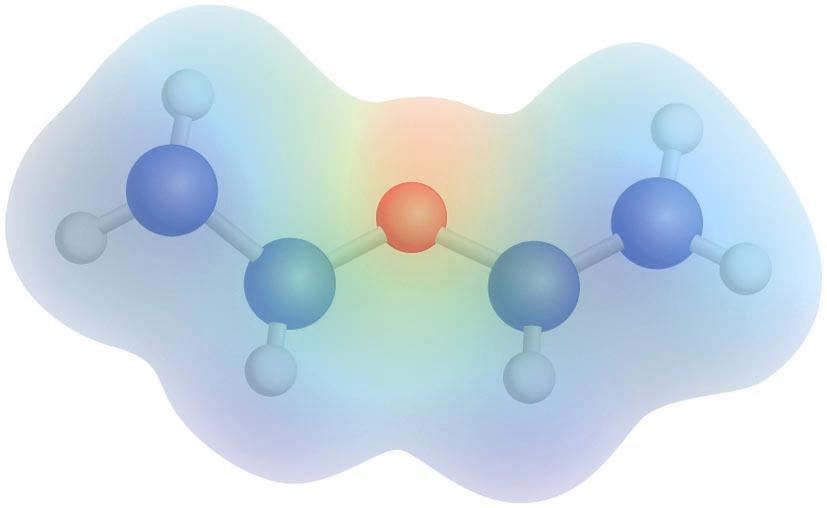
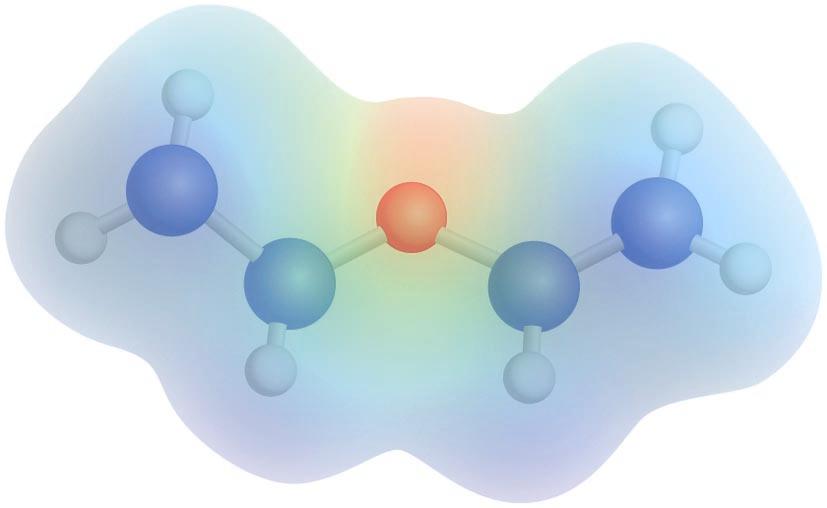
Eterren egitura uraren egitura angeluarraren antzekoa da, non oxigeno atomoaren hibridazioa sp3 den eta lotura-angelua tetraedrikotik hurbil dagoen. Hala, ur molekulan dagoen 104,5°-ko angeluarekin konparatuz, eterrek, R taldeen bolumenaren eraginez, angelu handiagoa dute. Eterretan agertzen diren C-O loturen ondorioz, eta egitura angeluarra dela kontuan izanda, momentu dipolarra dago (1,2-1,6 D); beraz, molekula polarrak dira.
Dietil eterraren potentzial elektrostatikoaren mapa: kolore gorriak dentsitate-karga negatiboa adierazten du, eta kolore urdinak, dentsitate-karga positiboa
Eterren irakite-puntuak dagozkien alkoholenak baino baxuagoak dira, ezin baitira eratu molekulen arteko hidrogeno-loturak. Aldiz, ur edo alkohol molekulekin hidrogeno-loturak era ditzakete; beraz, pisu molekular baxuko eterrak nahiko disolbagarriak dira uretan edo alkoholetan.
Eterrak, konposatu geldoak direnez, disolbatzaile egokiak dira erreakzio organikoetarako. Oro har, ez dute erreakzionatzen azido edo base diluituekin eta oxidatzaile edo erreduktore arruntekin. Disolbatzaile moduan erabiltzeaz gain, diesel- edo gasolina-motorretan erabiltzen den fluidoaren konposizioan dietil eterra erabiltzen da, erreketaren hasarazle lurrunkor gisa. t-butil metil eterrak ere erabilera garrantzitsua du: berun gabeko gasolinetan oktano-indizea handitzeko erabiltzen den gehigarria, hain zuzen ere.