espektro
- 1. Fis.
Goranzko edo beheranzko magnitude-ordenan antolatutako entitate edo propietateen banaketa, eta bereziki, uhin- edo partikula-erradiazio konplexu batean parte hartzen duten uhin-luzera, masa edo energia desberdineko erradiazioen banaketa; banaketa hori irudikatzen duen euskarria.
1. Fis.
- 1. Fis.
- Goranzko edo beheranzko magnitude-ordenan antolatutako entitate edo propietateen banaketa, eta bereziki, uhin- edo partikula-erradiazio konplexu batean parte hartzen duten uhin-luzera, masa edo energia desberdineko erradiazioen banaketa; banaketa hori irudikatzen duen euskarria.
Espektroa Edit
Egilea: Francisco Basterretxea
Erradiazio elektromagnetikoaren eta materiaren arteko elkarrekintzaren testuinguruan, espektro bat da substantzia batek xurgatutako, igorritako edo barreiatutako argi-intentsitatearen erregistroa, erradiazioaren frekuentziaren edo uhin-luzeraren arabera.
Erradiazio elektromagnetikoa edo argia espazioan zehar hedatzen den energia-mota bat da, eremu elektriko eta magnetiko oszilatzailez osatua. Espazio hutsean, energia hori uhin-forman hedatzen da, c = 2,9979 × 108 m/s-ko abiadurarekin. Erradiazio elektromagnetikoaren ezaugarri dira uhin-luzera eta ν frekuentzia, eta honela erlazionatzen dira: Beste ikuspuntu baten arabera, erradiazio elektromagnetikoaren energia fotoi-fluxu gisa har daiteke, eta fotoi bakoitzaren energia da, non h Plancken konstantea den, mekanika kuantikoaren funtsezko konstante bat. Erradiazio elektromagnetikoa hedatzen den uhin-luzeren tarteari espektro elektromagnetiko deritzo (espektro elektromagnetiko). Uhin-luzera handienak ( = 105–10-1 m) irrati-uhinek dituzte, eta horien atzetik, mikrouhinek ( = 10-3–10-1 m). Hurrengo luzeenak ( = 10-3–10-6 m) uhin infragorriak dira. Ondoren dator erradiazio ikusgaiaren tarte estua ( = (4–7) × 10-7 m), eta, horren atzetik, erradiazio ultramorea = 10-7–10-9 m). Uhin-luzera txikieneko erradiazioa X izpiek eta gamma izpiek ( = 10-9–10-14 m) osatzen dute. Aurreko tarteen balioak ez dira era zurrunean hartu behar, modu hurbilduan baizik.
Erradiazio elektromagnetikoak materiarekin (atomo eta molekulekin) interakzionatzen duenean, materiak erradiazioaren fotoiak xurgatu edo fotoi berriak igor ditzake, eta, hala, substantzia horren absortzio- edo emisio-espektroa sortzen da. Molekula batek fotoi bat xurgatu edo igorri ahal izateko, baldintza hau bete behar da derrigor: fotoiaren energiak molekularen bi energia-mailaren arteko diferentziaren berdina izan behar du, hau da, non E1 eta E2 molekularen energia kuantizatuak diren, eta fotoiaren energia. Baldintza hori betetzen bada, esaten da molekulak trantsizio espektroskopiko bat jasan duela E1 mailatik E2 mailara. Molekula batek energia-maila asko dituenez, hainbat frekuentziatako fotoiak xurgatu edo igor ditzake. Aurreko baldintzaz gain, trantsizio bat gertatzeko, molekula batek mekanika kuantikoak inposatutako zenbait baldintza teoriko bete behar ditu, hautaketa-arauak deitutakoak. Horren arabera, trantsizioak baimenduak izan daitezke (probabilitate altukoak) edo debekatuak (probabilitate gutxikoak). Substantzia baten absortzio-espektroa edo xurgapen-espektroa da substantzia horrek xurgatutako frekuentzien seriea. Oro har, grafikoki adieraz daiteke x-y grafiko batean: abszisetan, erradiazioaren uhin-luzerak edo frekuentziak daude, eta ordenatuetan, xurgatutako erradiazioaren intentsitatea.
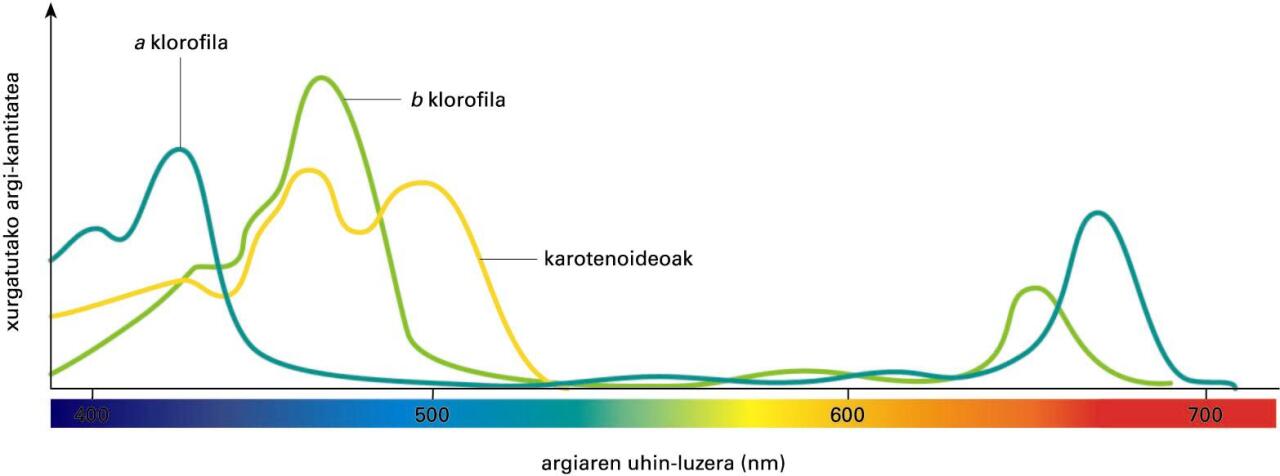
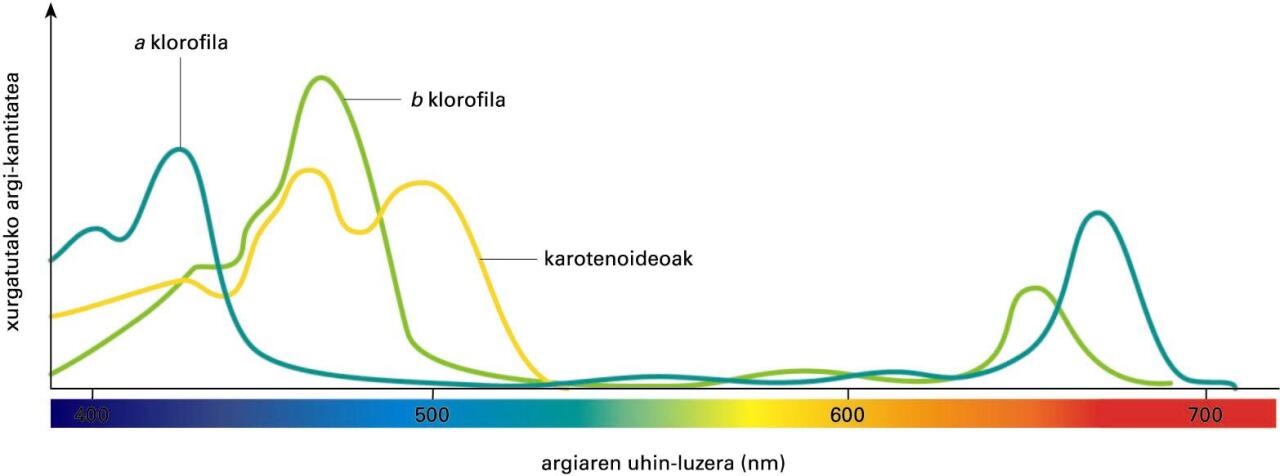
Absortzio-espektroaren adibide bat (klorofila eta karotenoen espektroa)
Substantzia baten igorpen-espektroa edo emisio-espektroa da substantzia horrek igorritako frekuentzien seriea. Lerro-espektroetan, absortzio- edo igorpen-lerroak frekuentzia diskretuetan agertzen dira. Batez ere gasetan behatzen dira, presio baxuetan. Espektro jarraitu batean, absortzio- edo igorpen-lerroak frekuentzia-tarte jarraituetan agertzen dira. Adibidez, berotutako solido batek frekuentzia-tarte zabalean eman ohi du emisio-espektro jarraitua. Banda-espektroetan lerroak taldeka agertzen dira, eta multzo edo bandak osatzen dituzte. Banda-espektroak tipikoak dira presio altuetako gas, likido edo solidoen absortzio-espektroetan.
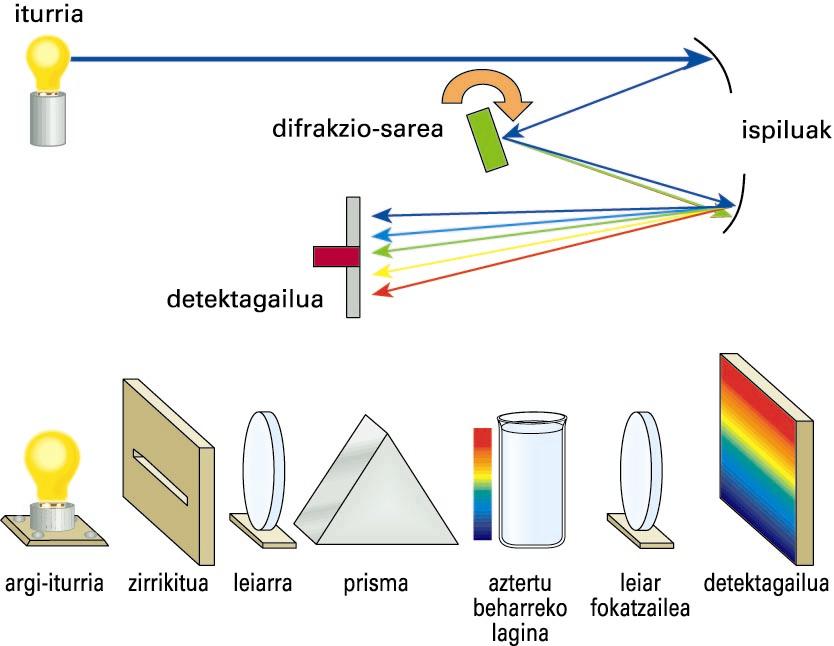
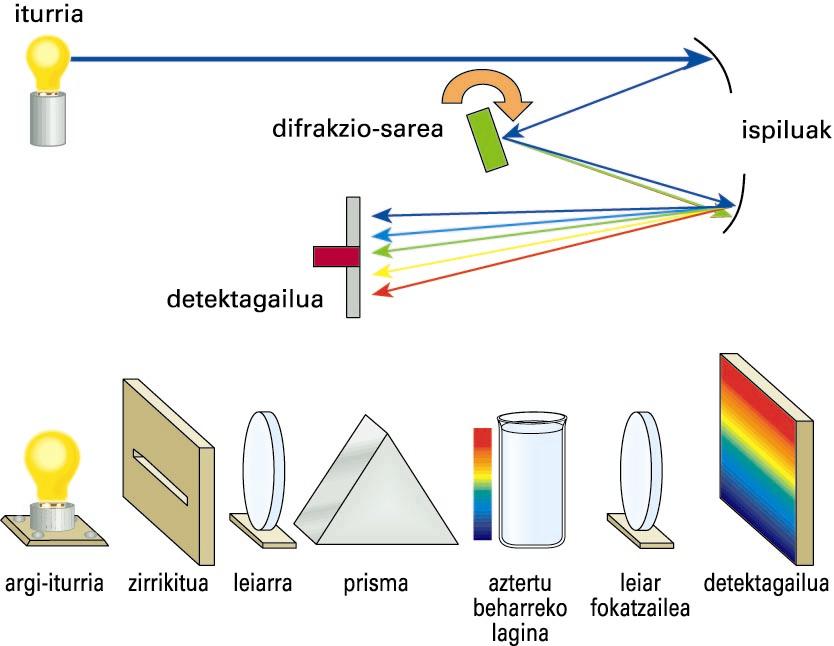
Substantzien espektroak erregistratzeko, espektrometroak edo espektrofotometroak erabiltzen dira. Ohiko konfigurazioan, absortzio-espektroak lortzeko, lehenik eta behin erradiazio elektromagnetikoa igortzen duen iturria edo lanpara behar da. Sarritan, goritasun-lanpara erabiltzen da, eta frekuentzia-tarte jarraituan emititzen du. Erradiazio horren frekuentziak espazialki barreiatzeko, prisma edo difrakzio-sare bat erabili ohi da. Frekuentzia eta intentsitate jakineko erradiazioak lagina zeharkatuko du ondoren, eta transmititzen den intentsitatea erradiazio-detektagailu batera iristen da (detektagailu fotoelektrikoa izan ohi da). Hala, frekuentzia bakoitzean laginak xurgatutako erradiazio-intentsitatea (iturriarena ken transmititutakoa) grafikoki irudika daiteke frekuentziaren (edo uhin-luzeraren) aurrean, absortzio-espektroa emateko. Espektrometro baten ezaugarri garrantzitsua da haren bereizmen-ahalmena, hau da, antzeko frekuentzia duten lerroak bereizteko gailuak duen ahalmena. Bereizmen altuko espektrometro batek bereizita erakutsiko ditu elkarrengandik oso hurbil dauden bi lerro, baina bereizmen baxuko gailu batek lerro bakarra balitz bezala agerraraziko ditu bi lerro horiek.
Absortzio-espektrometroaren bi adibide
Espektro batean lagin batek xurgatutako argiaren intentsitatea determinatzeko, Beer-Lambert legea erabiltzen da: , non I0 erradiazio erasotzailearen intentsitatea den; I, laginean zehar transmititutako intentsitatea; ε, absortzio-koefiziente molarra, substantziaren ezaugarria; [J], laginaren kontzentrazio molarra; eta z, erradiazioaren ibilbidearen luzera laginean zehar. Beer-Lambert legearen arabera, lagin batean zehar argiaren intentsitatea esponentzialki jaisten da laginaren kontzentrazioarekin eta laginaren lodierarekin.