elektrokimika
- 1. Kim.
Kimika fisikoaren adar bat, energia kimikoaren eta energia elektrikoaren arteko elkarrekintzak eta ioiek disoluzioan dituzten propietateak eta horien aplikazio industrialak aztertzen dituena.
- en electrochemistry
- es electroquímica
- fr électrochimie
- 1. Kim.
- Kimika fisikoaren adar bat, energia kimikoaren eta energia elektrikoaren arteko elkarrekintzak eta ioiek disoluzioan dituzten propietateak eta horien aplikazio industrialak aztertzen dituena.
Elektrokimika Edit
Egilea: Fernando Mijangos
Erreakzio kimiko gehienetan, elektroi-transferentzia gertatzen da, erredox prozesuak deiturikoak alegia. Erreakzio kimiko honek energia elektrikoa sor dezake zelula elektrokimiko batean gauzatzen denean. Pila galvanikoetan energia kimikoa energia elektriko bihurtzen da. Zelula elektrolitikoetan, ostera, elektrolisia gertatzen denean, erredox erreakzioa kanpotik eragindako energia elektrikoari esker gertatzen da.
Elektrokimika, beraz, erreakzio kimikoa eta energia elektrikoa uztartzen dituen kimikaren atala da; gehienbat erredox prozesuetan gertatzen diren oxidazio eta erredukzioetan —batera edo bi kupeletan banatuta— oinarritzen da.
Bateriek eta zelula galvanikoek indar elektroeragilea, tentsioa, ematen dute, beren baitan gertatzen diren erredox prozesuei esker; berez gertatzen ez den erredox erreakzio bati energia elektrikoa aplikatzean, berriz, elektrolisia gertatzen da.
Espresio honen bidez lotuta daude erredox erreakzio batean gertatzen den Gibbsen energia-aldaketa eta erreakzio kimiko horren bidez lor daitekeen lan elektriko maximoa: . Halaber, bi horiek honela lotzen dira erredox prozesuak sortzen duen indar elektroeragilearekin: , non n trukatzen diren elektroi-kopurua, F Faradayren konstantea eta E erreakzioak sortzen duen indar elektroeragilea diren.
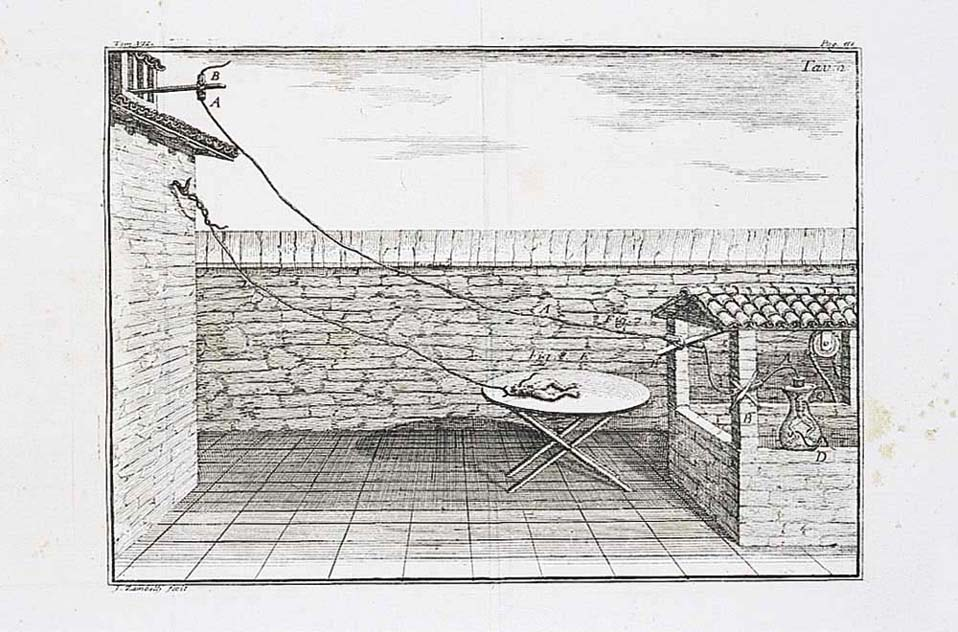
Elektrokimikaren garapen zientifikoan, zenbait zientzialari eta haiek egindako ekarpenak aipatu behar dira nahitaez, haiekin batera zientziaren arlo hau nola garatu den eta zer arlo ukitzen dituen adierazteko. Hauek dira garrantzitsuenak: Galvani mediku italiarrak igelekin egindako saioak (pila galvanikoa) (1791); Voltak diseinaturiko lehenengo pila; Faradayk egindako saioak eta haren legeak; Daniellen zink-kobrezko muntaia; Arrheniusek eta Ostwaldek argitaratutako elektrolitoen eroankortasunari buruzko teoriak; Bronsted eta Lowryren azido/baseei buruzko definizioak; eta, azkenik, gaur egungo erregai-zelulen pilak. Herdoiltze-prozesuak, halaber, erredox prozesuak dira. Horiek guztiak elektrokimikaren ikasgaiak dira.
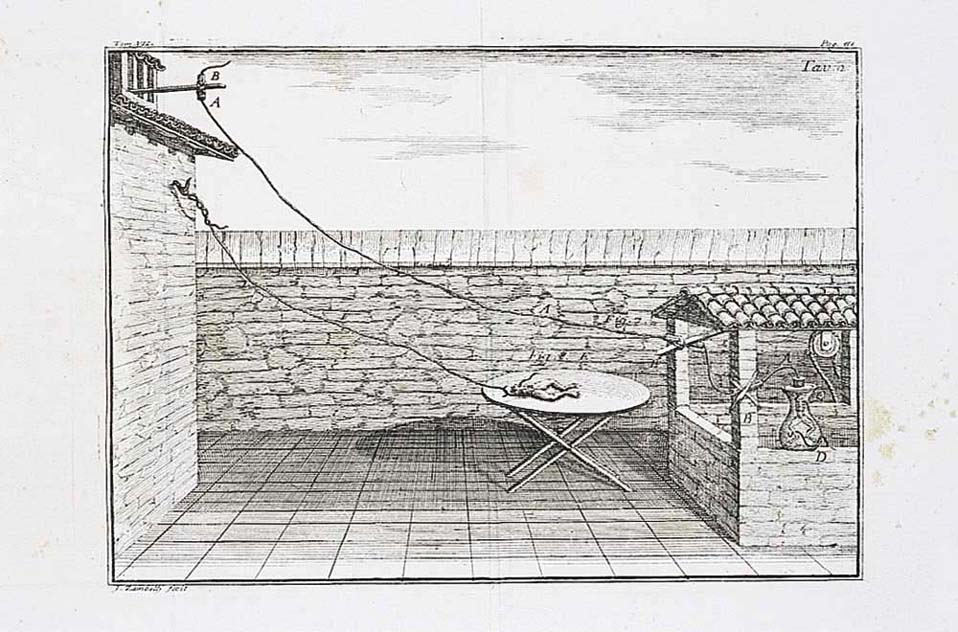
Galvanik igelekin egindako saioak
Atomo edo molekula batek elektroiak galtzen dituenean, oxidatu egin dela esaten da, hau da, substantzia horren oxidazio-zenbakia handiago bihurtzen da; karga elektrikoaren ikuspegitik natura neutroa denez, elektroi horiek beste substantziaren batek jasotzen dituenean substantzia hori (atomo edo molekula) erreduzitu egiten da. Elektroiak galtzen dituenari (atomo edo molekula) erreduktore deritzo, eta, alderantziz, elektroiak jasotzen dituenari, oxidatzaile . Bi prozesu horiek batera gertatzen dira elektroien transferentziak bat-batekoak baitira.
Egoera oxidatua + ne– Egoera erreduzitua
Erredox prozesu hauek oinarrizkoak dira bizidunetan gertatzen diren prozesu kataboliko eta anabolikoak, uraren elektrolisia eta, oro har, erreakzio kimikoek sor ditzaketen potentzial diferentziak ulertzeko.