Erreakzio kimiko batean modu askotako
substantziak egon daitezke: elementu zein konposatu solidoak, likidoak gasak
eta abar. Oro har, erreaktiboetako atomoak berrordenatu egiten dira; hau da,
lotura kimikoak apurtu eta berriak sortzen dira.
Erreakzio
kimiko bat ikurren bidez adierazi ahal izateko, ekuazio kimikoak erabiltzen
dira. Ekuazioetan, zein sustantziak eta zein proportziotan parte hartzen duten
adierazten da.
Aurreko
ekuazio kimikoan agertzen diren zenbakiek erreaktiboen eta produktuen arteko
proportzioak adierazten dituzte, hau da, erlazio estekiometrikoak.
Erlazio horiek
hauxe adierazten dute: A
substantziaren
a
molekulak
erreakzionatzeko, B substantziaren
b
molekula beharko dira, eta,
ondoren, C substantziaren
c
molekula eta D substantziaren
d
molekula sortuko dira.
Erreakzio
kimiko arruntetan, ekuazioaren bi aldeetako atomo-motak eta -kopuruak berdinak
dira, eta horri erreakzioa doitua egotea esaten zaio (ez da horrela izaten erreakzio
nuklearretan).
Erreakzio
batean zenbat erreaktibo gastatuko den eta zenbat produktu sortuko den
jakiteko, ekuazioaren estekiometria erabiliko dugu; baina kontuan hartu behar
da hasieran ipinitako kantitateak ez baldin badira estekiometriak agindutakoak
proportzioan kantitate urrienean dagoen erreaktiboa izango dela erreakzioa
mugatuko duena; eta horri erreaktibo mugatzailea esaten zaio.
Adibidez,
burdina metalikoak airearen oxigenoarekin erreakzionatutakoan, burdin oxidoa
eratzen da.
Adibide honetan, erreakzioa egurats zabalean eginez gero, erreaktibo
mugatzailea burdina izango da, nahi adina oxigeno baitago eguratsean.
Erreakzio-motak
Erreakzioak hainbat irizpideren arabera sailka
daitezke, baina beharbada sinpleena erreakzioan parte hartzen duten
substantzien arabera egitea da; horren arabera, erreakzio ez-organikoak eta
erreakzio organikoak bereizten dira. Horien artean nagusiak hauexek dira:
Azido-base erreakzioak
Hainbat teoria daude substantzien portaera
azidoa edo basikoa esplikatzeko. Arrheniusen arabera, uretan disolbatutakoan
ioiak ematen dituena da azidoa, eta basea,
berriz,
anioiak ematen dituena; Brönsted-Lowryren
arabera, azidoak protoi-emaileak dira, eta baseak protoi-hartzaileak; Lewisen
definizioaren arabera, azkenik, azidoak elektroi-bikote hartzaileak dira eta
baseak elektroi-bikote emaileak. Edozein kasutan, azido-base erreakzioak
azidoen eta baseen arteko erreakzioak dira.
Azido azetikoak (azidoa) amonio hidroxidoarekin
erreakzionatzen du (basea), eta amonio azetatoa (gatza) eta ura sortzen dira.
Erredox erreakzioak
Erreakzio hauetan, aldaketak gertatzen dira
atomoen oxidazio-zenbakietan, hau da, espezie kimikoen artean elektroiak
transferitzen dira.
Adibide honetan, iodoa () erreduzitu egiten da, haren
oxidazio-zenbakia 0tik 1era pasatzen baita, eta tiosulfato anioia () oxidatu, haren oxidazio-zenbakia +2tik
+5era pasatzen baita (egiatan, bi sufre-atomoen oxidazio-zenbakia 0 da, eta
beste biena +5; beraz, batezbestekoa +2,5 izango genuke).
Errekuntza-erreakzioak
Erredox erreakziotzat har daitezke. Erregai
den substantzia elementu oxidatzailearekin (normalean oxigenoa) konbinatutakoan,
beroa eta oxidatutako produktuak sortzen dira. Errekuntza osoa gertatzen
denean, berriz, erregai osoak oxigenoarekin erreakzionatu, eta karbono dioxidoa
eta ura sortzen dira.
Hauspeatze-erreakzioak
Substantzia bat (gatz bat adibidez) uretara
botatakoan, gerta daiteke guztiz disolbatzea edo ontziaren hondoan substantzia
solidoa agertzea
hauspeakina, hain
zuzen ere
. Substantziaren,
kantitatearen eta nahaste-kondizioen araberakoa da emaitza; hau da, ez da gauza
bera gatz arrunta, sodio kloruroa (),
gehitzea urari edo zilar kloruroa ()
gehitzea, disolbagarritasun ezberdina baitute.
Adibidez, zilar kloruroaren kasuan, hauxe da
hauspeatze-erreakzioa:
Zilar kloruro solidoa () uretara botatakoan, neurri batean zilar
katioitan () eta kloruro anioitan (), bietan, deskonposatzen da. Gehitutako
kantitatea nahikoa ez bada bi ioien kantitateak gatzaren disolbagarritasuna
gainditzeko, zilar kloruro guztia disolbatzen da. Baina kantitate handiagoan
gehituz gero, ioien arteko biderkadura disolbagarritasuna baino handiagoa da,
eta, azkenik, disolbatu gabeko zilar kloruro solidoa ikusiko dugu ontziaren
azpialdean; hauspeakina, hain zuzen ere.
Badira beste erreakzio-mota asko, hala nola
disoluzio-erreakzioak, ordezkatze-erreakzioak, adiziozkoak...
Erreakzioen zinetika
Erreakzio kimiko guztiak ez dira abiadura
berean gertatzen; badira ia bat-batean gertatzen diren erreakzioak eta badira,
kontrara, denbora luzea behar dutenak. Horretaz arduratzen den kimikaren alorra
zinetika kimikoa da. Erreakzioa gertatzeko, molekulen arteko talkak gertatu
behar du; gainera, erreakzionatuko duten taldeek elkarrekin topo egin behar
dute erreaktiboen eta produktuen arteko trantsiziozko egoera batean, eta
talkaren energiak nahikoa handia izan behar du trantsiziozko egoera horretara
heltzeko eta, hala, produktuak sortzeko. Hiru baldintza horiek batera betetzen
direnean, erreakzioa azkarra da, eta, bestela, motelagoa. Erreakzio baten
abiadura bizkortzeko hainbat modu daude: katalizatzaileak erabiliz, tenperatura
aldatuz, erreaktiboen kontzentrazioak aldatuz... Hidrogeno eta oxigeno gasak
elkarrekin daudenean, giro-tenperaturan, ez da erreakziorik gertatzen, baina
platino-hautsa gehitutakoan erreakzioa bortizki gertatzen da, leherketa baten
moduan. Platinoaren gainean oxigenoa adsorbatzen da, eta oxigeno diatomikoaren
atomoen arteko loturak ahuldu eta errazago erreakzionatzen du hidrogenoarekin,
eta ura ematen du. Erreakzioaren bukaeran, platinoa hasieran bezala egongo da,
hau da, berreskuratu egingo da. Erreakzio bat gertatzeko jarraitutako bideari
erreakzioaren mekanismo esaten zaio, eta, zenbait kasutan, katalizatzaileak
mekanismo horretan eragiten du.
Abiadura erreaktiboak desagertzeko abiadura
moduan edo produktuak sortzeko abiadura moduan defini daiteke, hau da,
eta abiadura hori erreaktiboen
kontzentrazioarekin lotuta egongo denez, oro har hau da abiadura-ekuazioa:
k
abiadura-konstantea
izanik, eta
m
eta
n
abiaduraren erreakzio-ordenak bi erreaktiboekiko.
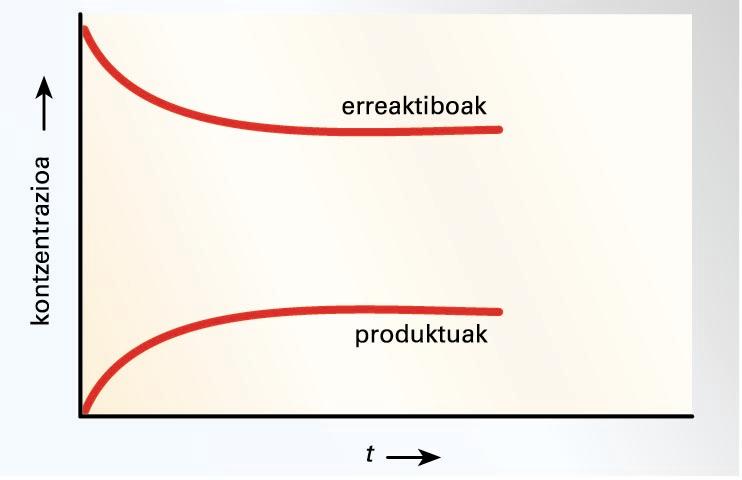
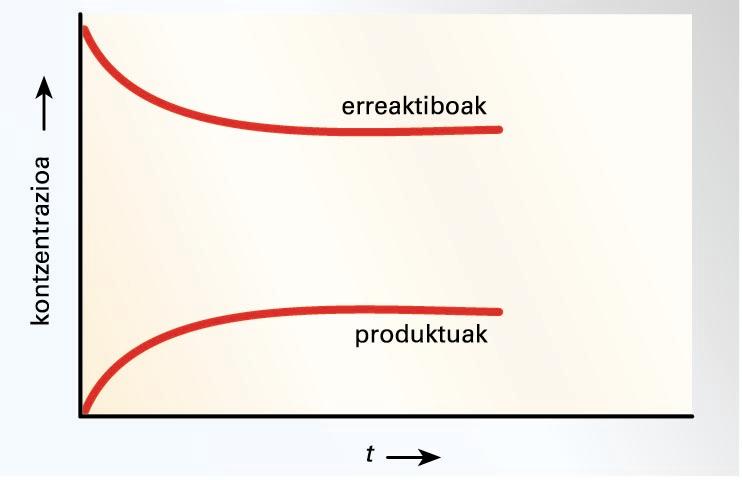
Erreakzioa gertatzen hasten denean, erreaktiboen
kontzentrazioak txikituz doaz pixkanaka, eta produktuenak, aldiz, handituz.
Hortaz, produktuen arteko talkak ugarituz doaz, eta idatzita dagoenaren
alderantzizko erreakzioa gerta daiteke. Beraz, erreakzioa idatzitako bi
noranzkoetan gertatzen da, bakoitzean abiadura batez. Erreakzio zuzenaren
abiadura txikituz doa pixkanaka, eta alderantzizkoarena handituz. Bi abiadurak
berdindutakoan, itxuraz behintzat ez da erreakziorik gertatzen, eta erreakzioa
orekara iritsi dela esaten da.
Erreakzio kimikoen bilakaera
Erreakzioen energia
Erreaktiboetako loturak apurtu eta
produktuetako lotura berriak sortutakoan, energia-balantzea egin beharko da;
hau da, bukaerako egoeran produktuek energia gehiago izan dezakete erreaktiboek
baino, edo gutxiago, edo berdin. Lehenengo kasuan, erreakzioa gertatzeko
energia eman beharko zaio sistemari, eta erreakzio-mota horri erreakzio
endotermikoa esaten zaio; bigarrenean, aldiz, erreakzioa gertatutakoan energia
askatuko da, eta erreakzioa exotermikoa dela esan ohi da. Azkenik, energia ez
bada xurgatzen ez askatzen, erreakzioa atermikoa izango da. Erreakzioetan
trukatutako energiaz arduratzen den kimikaren atala termokimika da. Energia
bero moduan trukatuko da normalean, eta laborategian gehienetan esperientzia
guztiak presioa konstante mantenduz egiten direnez, balantze energetikoa
zehaztuko duen magnitudea entalpia-aldaketa izango da,
Metanolaren errekuntza (lehenengo erreakzioa)
exotermikoa izango da; hidrazinaren formazio-erreakzioa, berriz, endotermikoa.
Erreakzioen etekina
Paperean idatzitako ekuazio kimikoak
erreaktiboen eta produktuen arteko proportzioa adierazten du, baina, askotan,
erreakzio-ontzian jarritako erreaktibo guztiak ez du erreakzionatzen, edo beste
substantzia desegokiren bat sortzen da. Beraz, gauza bat da erreakzio ideala,
eta bestea benetan gertatzen dena. Beraz, erreakzio batean benetan sortzen den
produktu-kantitatea teorikoa baino txikiagoa da beti, eta hori erreakzioaren
etekinak ematen du.