oxígeno
- 1. Kim.
Zenbaki atomikoa 8 duen elementu kimiko ez-metalikoa, 16 taldeko burua dena. Forma ohikoena bi atomoko molekula da (O2), eta orduan gas kolorge, usaingabe eta zaporegabea da. Lurreko elementurik ugariena da (% 49,2 pisuan), eta O2 forman, airearen osagai nagusietakoa (% 21 bolumenean). Oxigenoa duen konposatu ugariena ura da. Bizirako ezinbestekoa da, arnasketarako behar delako eta funtsezko konposatu askoren osagaia delako (biomolekulak, ura, karbono dioxidoa eta abar). Atmosferako oxigeno-iturri nagusia fotosintesia da. Ozono (O3) forman ere badago.

- 1. Kim.
- Zenbaki atomikoa 8 duen elementu kimiko ez-metalikoa, 16 taldeko burua dena. Forma ohikoena bi atomoko molekula da (O2), eta orduan gas kolorge, usaingabe eta zaporegabea da. Lurreko elementurik ugariena da (% 49,2 pisuan), eta O2 forman, airearen osagai nagusietakoa (% 21 bolumenean). Oxigenoa duen konposatu ugariena ura da. Bizirako ezinbestekoa da, arnasketarako behar delako eta funtsezko konposatu askoren osagaia delako (biomolekulak, ura, karbono dioxidoa eta abar). Atmosferako oxigeno-iturri nagusia fotosintesia da. Ozono (O3) forman ere badago.
Oxigenoa Edit
Egilea: Aintzane Goñi
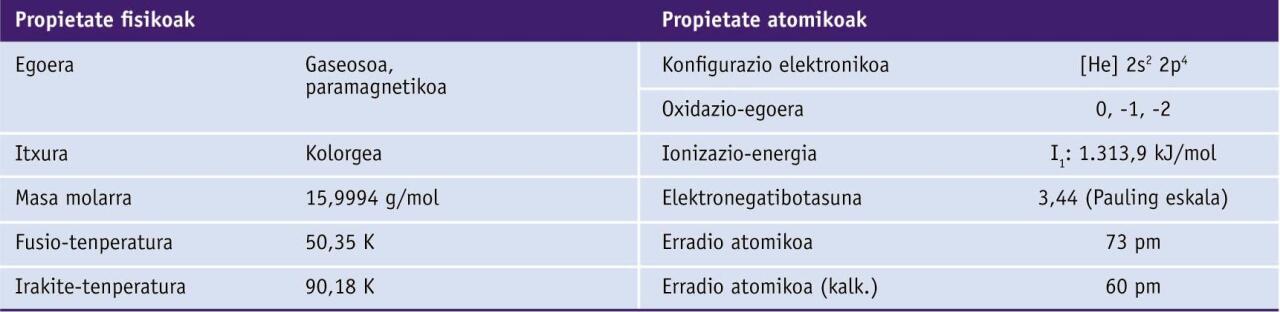
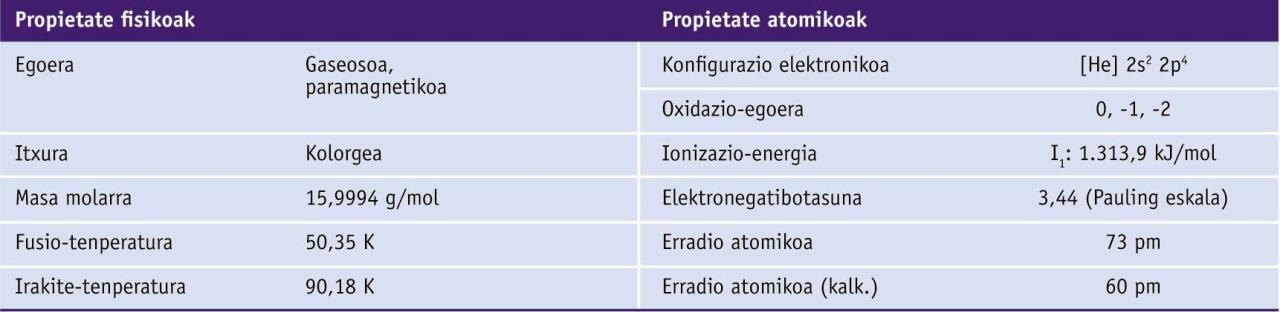
Propietate fisiko eta kimikoak
Bi forma alotropiko ditu, biak gaseosoak eta oxidatzaile onak: O2 dioxigenoa edo oxigeno gasa eta O3 trioxigenoa edo ozonoa. Elementuaren oxidazio-egoera nagusiak hauek dira: −2, −1 eta 0.
Oxigenoaren zenbait propietate
Elementu elektronegatiboa da. Metalekin erreakzionatzen du, eta, oro har, izaera ionikoa duten oxidoak eratzen ditu.
Ugaritasuna eta produkzioa
Oxigenoa atmosferako airetik eskuratzen da, destilazio zatikatuaren bidez. Aire lehorrean, itsas mailan, oxigenoaren portzentajea % 20,946 da bolumenari dagokionez. Hala ere, Lur planetaren antzinako atmosferan ez zegoen oxigenorik, atmosfera erreduzitzailea baitzen. Duela 2,5 × 109 urte, landare berdeen fotosintesiaren eraginez, atmosferako CO2-a O2 bilakatzen hasi zen. Gaur egungo oxigeno-ugaritasuna duela 5 × 108 urtekoa da. Animaliek, gizakiak barne, arnasketarako beharrezkoa dugu oxigenoa, baina beti kontzentrazio-muga batzuen artean: % 17 baino kontzentrazio txikiagoetan asfixia gertatzen da, baina % 25 baino kontzentrazio altuagoetan sutan hasteko arrisku handia dago. Arnasketan, gizakien biriketan, odoleko hemoglobinaren burdinak O2-a erakartzen du, eta gorputz osora garraiatzen. Espezie gehienek burdina erabiltzen dute oxigenoaren garraiorako, baina zenbait kasutan (artropodoen edo moluskuen kasuan, adibidez) kobrea erabiltzen da; horregatik, animalia horien odola urdina da.
Industrian, oxigeno gaseosoaren aplikazioak ugari dira: burdinaren eta altzairuaren produkzioan, beste metal batzuen ekoizpen eta fabrikazioan (ebaketa, soldatzea…), produktu kimiko askoren lorbideetan eta beste oxidazio-prozesuetan, ur-tratamenduetaneta abarretan.
Ozonoa (O3), atmosferako altitude baxuetan, soilik 0,04 ppm-ko kontzentrazioan dago, baina, estratosferan, 25 eta 35 km-ko altuera-tartean, kontzentrazioa handiagoa da, 8 ppm ingurukoa. Eskualde horri ozono-geruza deritzo. Ozono estratosferikoak eguzki-izpi ultramoreak xurgatu egiten ditu; horri esker, Lurreko bizidunak erradiazio kartzinogeno eta erregarri horretatik babesten ditu, eta atmosferaren oreka termikoari eusten dio. O3-a oxidatzaile sendoa denez, batzuetan Cl2-aren ordez erabili da edateko ura purifikatzeko, ez baitu zaporerik eta ez baitu sortzen minbizi-eragileak diren konposatu organokloraturik. Hala ere, ozonoa ezegonkorra denez, tratatutako uretatik azkar desagertzen da, eta ez du babesik bermatzen luzarorako.
Lurrazaleko alde solido eta likidoan ere oxigenoaren ugaritasuna handia da, masaren % 45,5, alegia, baina ez elementu gisa, konbinatuta baizik. Oxigenoa gai da, He, Ne eta Ar-arekin izan ezik, beste elementu guztiekin konposatuak eratzeko.
Konposatu nagusiak
Oro har, oxigenoaren konposatuak horrenbeste izanik, beste elementuen azterlanetan zatika deskribatzeko ohitura dago. Hala ere, gai honetan, ura (H2O) eta ur oxigenatua (H2O2) dira bereziki aipagarrienak.
Ura Lurrean dagoen likido arrunt bakarra da. Erreakzio biokimikoetarako disolbatzailea izanik, ura ezinbestekoa da bizidunentzat. Disolbatzaile polar nagusiena izateaz gain, bero-ahalmen handiagatik hoztaile egokia izaten da prozesu kimiko eta industrialetan. Hidrogeno-loturaren eraginez, fusio- eta irakite-tenperatura bereziki altuak ditu, eta egoera solidoan likidoan baino dentsitate txikiagoa du. Izotzak uraren gainean flotatzen duenez, Ipar poloa ez da itsasoan urperatu. Gainera, ura goitik behera izozten da, eta, hala, izotz azpiko uretako bizidunak babesten ditu.
Hidrogeno peroxidoa edo ur oxigenatua likido kolorge likatsua da, oso korrosiboa. Ez da termodinamikoki egonkorra, astiro desmutatzen da, eta ura gehi oxigenoa ematen du:
2 H2O2 → 2 H2O + O2
Kimika-arloan, oxidatzaile eta erreduktore modura jokatzeaz gain, peroxokonplexuak eratzeko ere erabiltzen da. Industria mailan, produktu kimiko garrantzitsua da, prozesu askotan erreaktibo gisa parte hartzen du. Papergintzan, zuritzailea da, etxe-garbiketarako zenbait produkturen osagaia ere bada, eta ilearen dekoloratzaile gisa ere erabiltzen da.
Oxigeno gaseosoaren aplikazioak ugari dira burdinaren eta
altzairuaren produkzioan