enzima
- 1. Biokim.
Erreakzio biokimikoak katalizatzen dituen molekula. Entzima bakoitza erreakzio jakin baterako edo antzeko erreakzio-multzo baterako espezifikoa da.
1. Biokim.
-

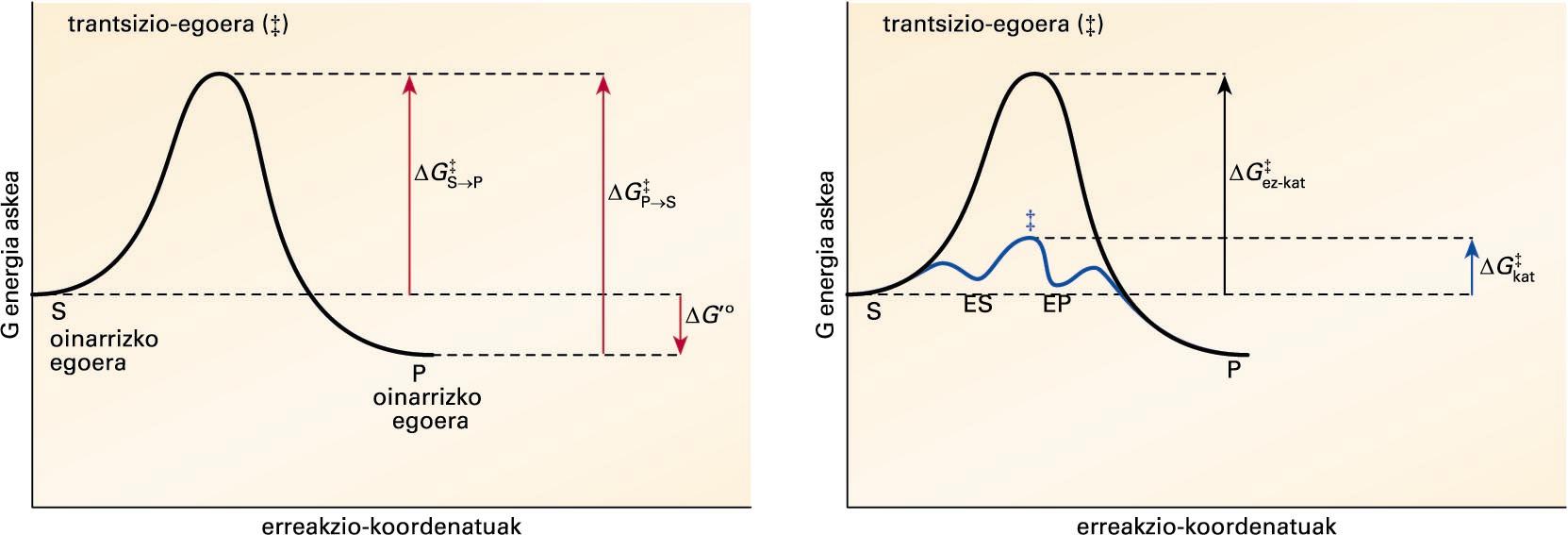
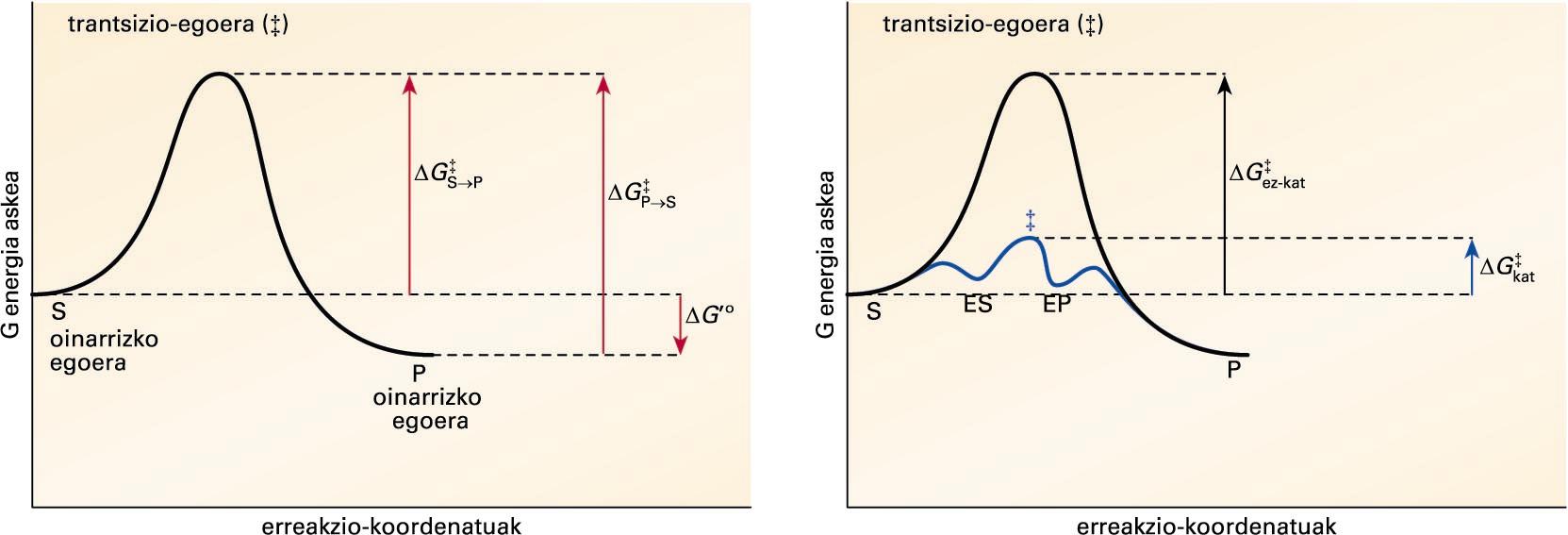
S ↔ P erreakzio kimikoaren bilakaeran(erreakzio-koordenatuak) gertatzen den G energia askearen aldaketa. S eta P puntuak substratu eta produktuaren oinarrizko egoeraren energia askea dira.Ezkerreko ... -
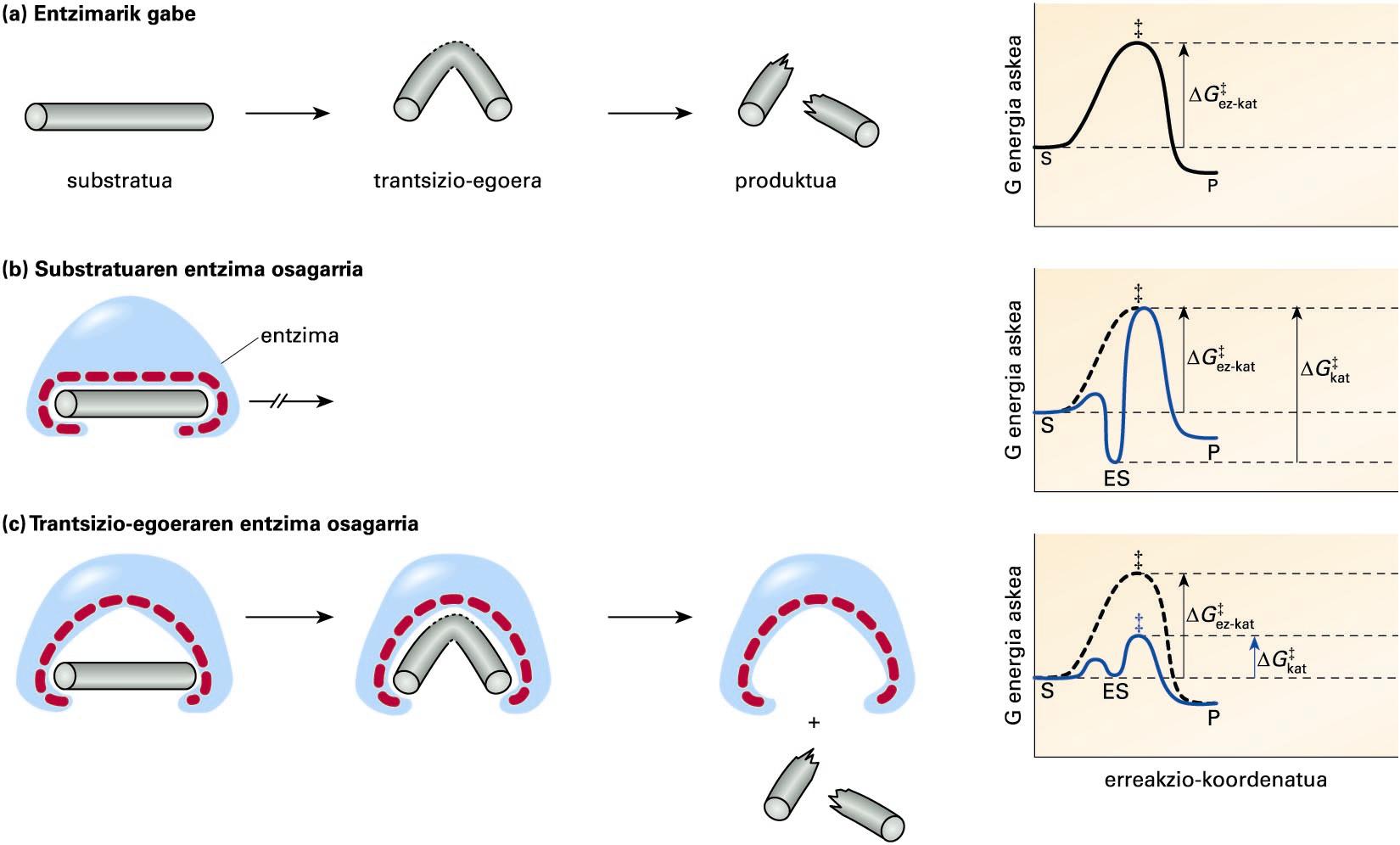
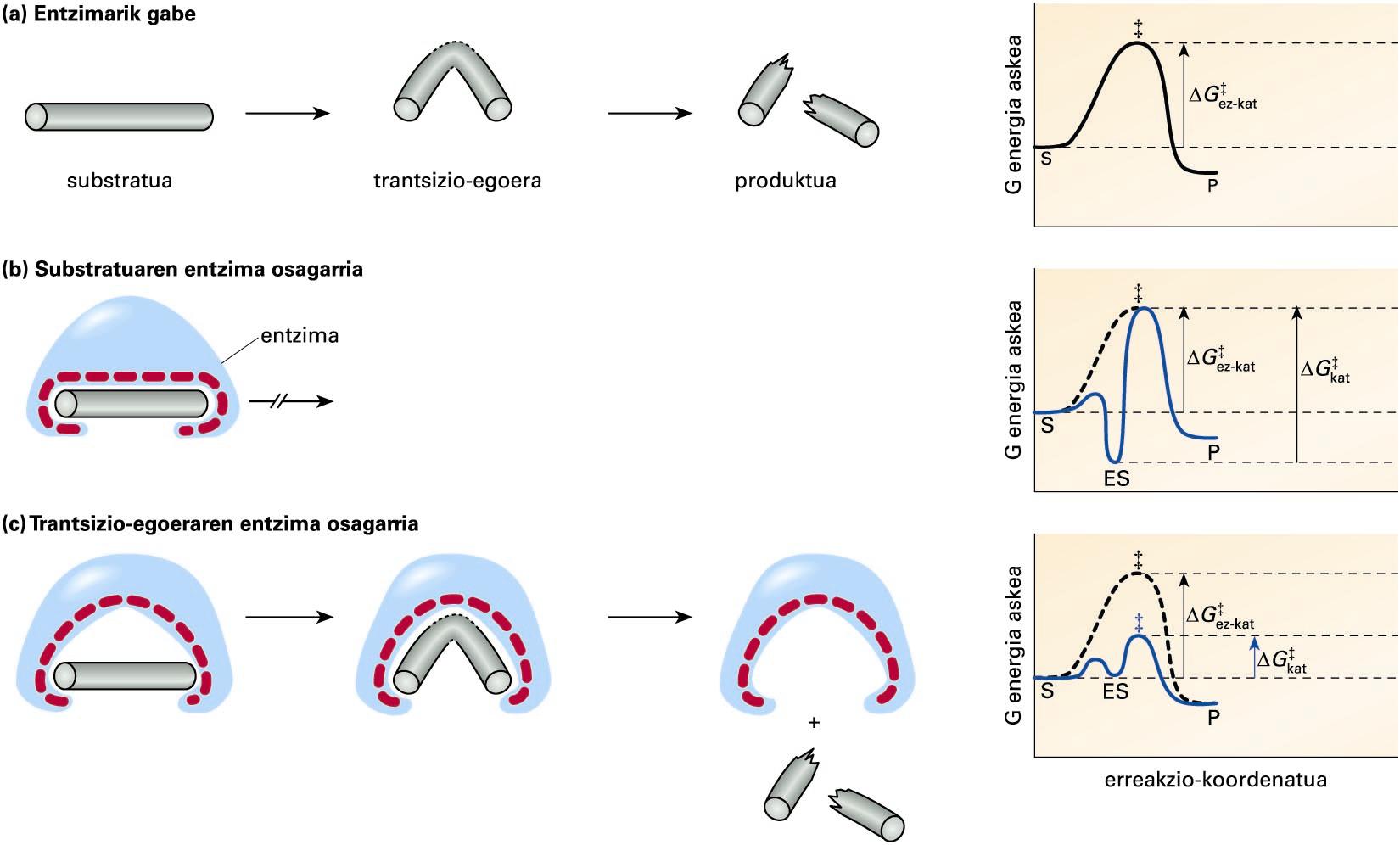
Erreakzio hipotetiko baten substratu, trantsizio-egoera etaproduktuaren egiturak: a kasuan, entzimarik gabeko erreakzio batean; b kasuan,giltza-sarraila ereduaren araberako erreakzioan; eta c kasuan, doitzeinduzituaren ereduaren araberakoan ... -
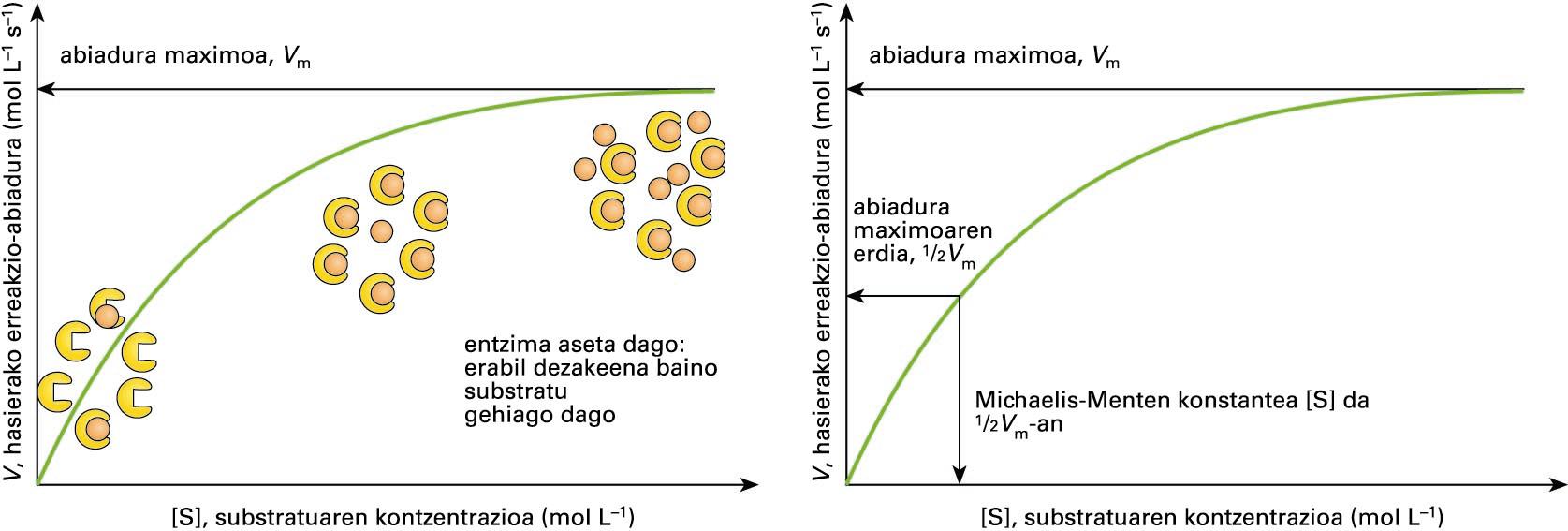
![Erreakzio entzimatikoaren abiaduraren (<span style="font-style:italic">V</span>) etasubstratuaren kontzentrazioaren ([S]) arteko erlazioa. Erreakzioak lor dezakeenabiadura maximoa da <span style="font-style:italic">V</span><sub>m</sub>. Eskumako grafikoan, Michaelis-Mentenkonstanteari dagokion erreakzioaren abiadura eta substratuaren kontzentrazioaadierazi dira](https://zthiztegia.elhuyar.eus/static/uploads/022964_artik-image006.jpg)
Erreakzio entzimatikoaren abiaduraren (V) etasubstratuaren kontzentrazioaren ([S]) arteko erlazioa. Erreakzioak lor dezakeenabiadura maximoa da Vm. Eskumako grafikoan, Michaelis-Mentenkonstanteari dagokion erreakzioaren abiadura eta substratuaren kontzentrazioaadierazi ... -
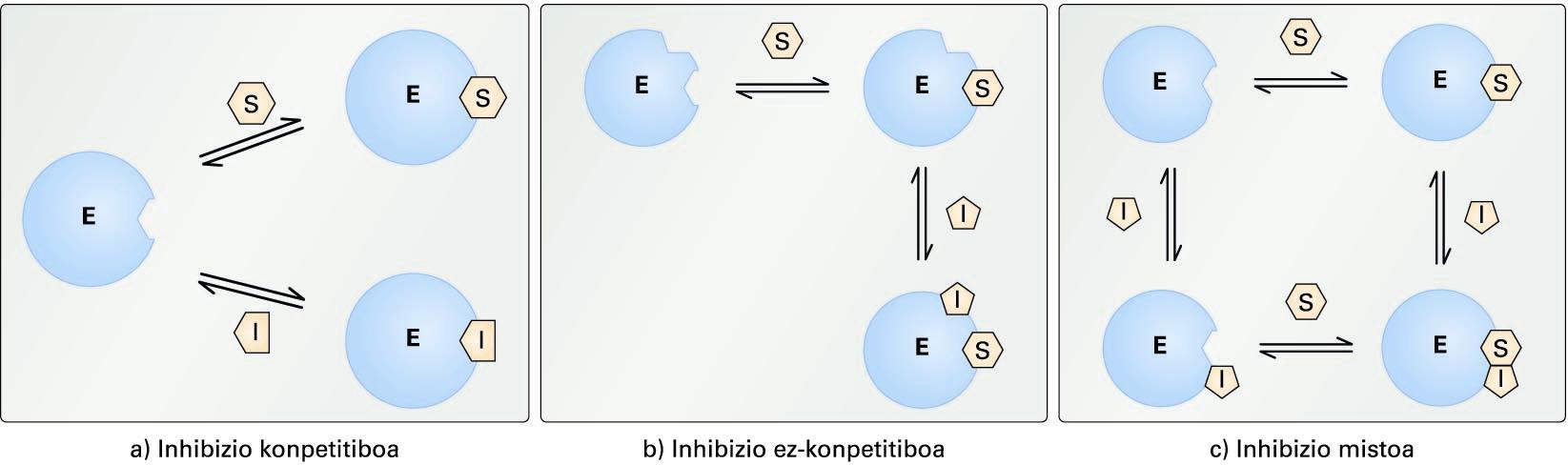
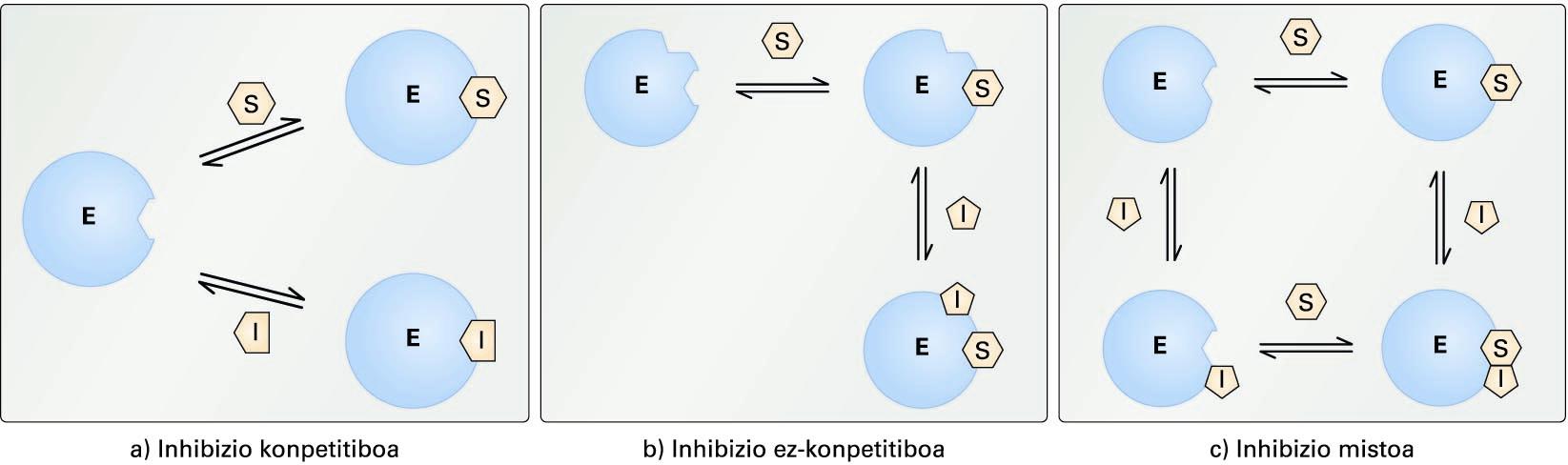
Inhibizio itzulgarrien ereduak. (a) inhibizio konpetitiboa,(b) inhibizio ez-konpetitiboa eta (c) inhibizio mistoa. E zirkulu urdinakentzima irudikatzen du, eta S-k eta I-k, substratua eta inhibitzailea ...
- 1. Biokim.
- Erreakzio biokimikoak katalizatzen dituen molekula. Entzima bakoitza erreakzio jakin baterako edo antzeko erreakzio-multzo baterako espezifikoa da.
Entzima Edit
Egilea: Kerman Aloria
Entzimak sistema biologikoetan gertatzen diren erreakzio kimikoak katalizatzen dituzten molekulak dira. Zeluletako erreakzio kimiko gehienetan entzimen parte hartzea beharrezkoa da, zelularen denbora-eskalari dagokionez erreakzio horien berezko abiadura oso geldoa baita. Erreakzio entzimatikoetan parte hartzen duten hasierako molekulei substratu deritze, eta amaierakoei, produktu. Katalizatzaile ez-biologiko askok ez bezala, entzimek substratuarekiko espezifikotasun-maila oso altua erakusten dute, eta pH-baldintza leunetan eta disoluzio urtsuetan lan egiten dute. Bestalde, katalizatzaile diren heinean, entzimek erreakzioaren aktibazio-energia gutxituz erreakzioaren abiadura azkartzen dute, ez dira prozesuan zehar agortzen, eta ez dute erreakzioaren oreka kimikoa aldatzen.
Biokimikaren historiaren zati handi bat entzimen ikerkuntzak bete du. Katalizatzaile biologikoak lehen aldiz XVIII. mendearen bukaeran aipatu eta deskribatu ziren, urdailaren sekrezio edo jariakinen bidezko okelaren eta landare-erauzkinen bidezko almidoiaren digestioaren ikerkuntzan. 1850. hamarkadan, Louis Pasteurrek postulatu zuen legamiek eragindako azukrearen hartzidura alkoholikoa hartzigarri izeneko "bizi-indarrek" (vital force) katalizatzen zutela. Hala ere, 1897an, Eduard Buchnerrek aurkitu zuen legamien erauzkinek ere, hau da, zelula gabeko sistemek, hartzidura-prozesuak eragin zitzaketela. Aurkikuntza horren ondorengo pausoa entzimen izaera kimikoa zehaztea izan zen. 1926an, James B. Sumnerrek ureasa entzima isolatu eta kristalizatu zuen. Ureasaren kristalak proteinaz bakarrik osatuta zeudela aurkitu, eta entzima guztiak proteinak zirela postulatu zuen. 1930. hamarkadan, bai James B. Sumnerrek berak, bai John Morthrop eta Moses Kunitzek frogatu zuten katalasa, pepsina, tripsina eta kimiotripsina entzimak proteinak zirela; horrenbestez, entzimen izaera kimikoari buruzko James B. Sumnerren postulatuak baieztatu ziren. XX. mendean, entzimei buruzko ikerketak berebiziko garrantzia izan du biokimikaren garapenean, milaka entzima purifikatu eta karakterizatu dira, eta entzimen erabilera biozientzien alor askotara zabaldu da.
Entzimen egitura eta mekanismo katalitikoa
Egitura
Gaur egun arte deskribatu diren entzima guztiak proteinak dira (erribozima izeneko eta gaitasun katalitikoa duten RNA-molekula gutxi batzuk izan ezik), eta portzentaje handi batean, proteina globularrak. Edozein proteinak bezala, aminoazido-kate luze lineal moduan sintetizatu ondoren, entzimak bere funtzioa betetzeko behar duen egitura tridimentsionala hartuko du. Entzima askok egitura kuaternarioa dute, hau da, kate polipeptidiko biren edo gehiagoren arteko elkarrekintzek egonkortutako konplexuak eratzen dituzte. Entzimak katalizatzen dituzten erreakzioen substratuak baino askoz handiagoak izan ohi dira, baina katalisi-prozesuan aminoazido gutxi batzuek besterik ez dute parte hartzen. Aminoazido horiei aminoazido katalitiko deritze, eta aminoazido katalitikoak dauden, substratua lotzen duen eta erreakzioa gertatzen den entzimaren eskualdeari, gune katalitiko edo gune aktibo.
Entzima batzuek, kate polipeptidikoaz gain, kofaktore izeneko molekula ez-proteikoak behar dituzte aktibo izateko. Kofaktoreak molekula ez-organikoak (ioi metalikoak) eta organikoak izan daitezke. Kofaktore organikoen multzoan, bi mota bereizten dira: batetik, talde prostetikoak, entzimaren egituraren parte diren eta modu sendoan lotuta daudenak (hemo taldea, adibidez); bestetik, koentzimak, modu ahulean lotuta daudenak (bitamina asko). Entzimaren zati proteikoari apoentzima deritzo, eta gaitasun katalitikoa duenari (proteina + kofaktorea), holoentzima.
Mekanismo katalitikoa
Sarreran aipatu denez, entzimek erreakzioaren abiadura azkartzen dute, baina ez dute erreakzioaren oreka kimikoa aldatzen. Katalisi entzimatikoaren funtzionamendua ulertzeko, oso garrantzitsua da erreakzioaren oreka eta erreakzioaren abiadura baldintzatzen duten parametroak desberdintzea.
S ↔ P erreakzio kimikoaren bilakaeran (erreakzio-koordenatuak) gertatzen den G energia askearen aldaketa. S eta P puntuak substratu eta produktuaren oinarrizko egoeraren energia askea dira. Ezkerreko atalean, (‡) sinboloak erreakzioa gertatzeko gainditu behar den trantsizio-egoeraren energia askearen maila adierazten du. ΔG‡S→P eta ΔG‡P→S sinboloek S→P eta P→S erreakzioen aktibazio-energia adierazten dute, eta, ΔG°’-k, S eta P-ren oinarrizko egoeren arteko energia askearen diferentzia. Eskumako irudian, S→P erreakzio kimikoaren energia askearen aldaketa, entzima dagoenean ( ΔG‡kat, urdina) eta entzima ez dagoenean (ΔG‡ez-kat, beltza), irudikatu da. Entzima-substratu (ES) eta entzima-produktu (EP) konplexuen trantsizio-egoeraren energia askearen maila (‡, urdina), katalizatu gabekoarena (‡, beltza) baino baxuagoa da
Demagun S ↔ P erreakzio kimiko sinplea. Aurreko irudiaren lehen atalean, S ↔ P erreakzioan gertatutako energia aske estandarraren aldaketa deskribatu da. Erreakzioaren abiapuntuari (S-tik P-ra eta P-tik S-ra) oinarrizko egoera deritzo, eta oinarrizko bi egoera horien arteko energia aske estandarraren diferentziari, ΔG’°. S eta P-ren arteko orekak haien oinarrizko egoeraren arteko energia aske estandarraren diferentzia adierazten du. Kasu honetan, P-ren oinarrizko egoeraren energia aske estandarra S-rena baino baxuagoa denez, oreka P-ren aldekoa izango da. Baina aldeko oreka batek ez du determinatzen S → P eraldaketa azkarra denik. Erreakzioaren abiadura beste parametro baten menpekoa da, trantsizio-energiaren menpekoa, hain zuzen. Irudiaren bigarren atalean, entzima dagoenean (urdina) eta ez dagoenean (beltza), erreakzioaren trantsizio-energia irudikatu da. Bai S-k, P bihurtzeko, zein P-k, S bihurtzeko, egoera bien artean dagoen energia-hesia gainditu behar dute, erreakzioa gerta dadin beharrezko diren transformazioek eskatzen duten energia, hain zuzen. Energia-hesi horren puntu gorenari trantsizio-egoera deritzo, eta oinarrizko egoeraren eta trantsizio-egoeraren arteko energia-mailen diferentziari, aktibazio-energia (ΔG‡). Erreakzioaren abiadura aktibazio-energiaren araberakoa da, zenbat eta aktibazio-energia altuagoa, orduan eta abiadura baxuagoa. Grafikoan ikus daitekeenez, entzimek, ES (entzima-substratu) eta EP (entzima-produktu) konplexuak eratuz, erreakzioaren aktibazio-energia gutxitu egiten dute (ΔG‡kat < ΔG‡ez-kat).
Aktibazio-energia erreakzio kimikoak gainditu behar duen energia-hesia da, baina prozesu biologikoetan ezinbestekoa den hesia. Aktibazio-energiaren presentziak konplexu makromolekular edota egitura konplexuen existentzia baimentzen du. Hori gabe, egitura sinpleagoek daukaten oinarrizko egoera baxuagoen eraginez, konplexu makromolekularrak espontaneoki egitura sinpleagoetara itzuliko lirateke.
Erreakzio entzimatikoetan ES konplexuak bi ezaugarri bete behar ditu: alde batetik, erreakzioaren aktibazio-energia gutxitu eta, era berean, entzimak substratuarekiko duen espezifikotasuna mantendu.
1894. urtean, Emil Fischerrek giltza-sarraila eredua postulatu zuen, hau da, entzima eta substratuaren arteko osagarritasun estrukturala. Eredu horrek molekula biren arteko elkarrekintza espezifikoa eta esklusiboa azaldu dezake, baina osagarritasun estrukturalak ez du aktibazio-energiaren gutxitzea baimentzen. Katalisi entzimatikoaren eredu modernoa, doitze induzituaren eredua (induced fit model) izenekoa, Daniel Koshlandek proposatu zuen 1958an. Eredu berri horretan, osagarritasun estrukturala entzimaren eta substratuaren trantsizio-egoeraren artekoa da. Era honetan, entzimak substratuarekiko espezifikotasuna mantendu eta, aldi berean, aktibazio-energia gutxitu dezake, hurrengo irudian ikus daitekeenez.
Erreakzio hipotetiko baten substratu, trantsizio-egoera eta produktuaren egiturak: a kasuan, entzimarik gabeko erreakzio batean; b kasuan, giltza-sarraila ereduaren araberako erreakzioan; eta c kasuan, doitze induzituaren ereduaren araberakoan. Eskumako grafikoetan, erreakzio bakoitzaren bilakaeran (erreakzio-koordenatua) gertatzen den G energia askearen aldaketa ikus daiteke. S, ES, P eta ‡ sinboloek, substratu, entzima-substratu konplexu, produktu eta trantsizio-egoeraren energia askea adierazten dute, eta ΔG‡ez-kat eta ΔG‡kat sinboloek, katalizatu gabeko eta katalizatutako erreakzioen aktibazio-energia
(a) kasuan, entzimarik gabeko erreakzio hipotetiko bat irudikatu da, eta eskumako grafikoan, erreakzio horren aktibazio-energiaren aldaketa (ΔG‡). Entzima eta substratua erabat osagarriak direneko kasuan, (b) atalean, ES konplexua oso espezifikoa izango da, baina modu berean oso egonkorra, eta erreakzioa gertatzeko behar den aktibazio-energia entzimarik gabeko erreakzioarena baino handiagoa izango da (ΔG‡kat > ΔG‡ez-kat). Entzimak berak ez dio substratuari uzten trantsizio-egoeran duen egitura lortzen, eta erreakzioa ES konplexuan geldituko da. (c) kasuan, entzima eta substratuaren trantsizio-egoera osagarri direneko kasuan, entzima eta substratuaren arteko espezifikotasuna mantendu egingo da, substratu desberdinek trantsizio-egoera desberdinak baitituzte. Era berean, entzimak substratua trantsizio-egoerara heltzea erraztuko du, eta erreakzioaren aktibazio-energia gutxituko da (ΔG‡kat < ΔG‡ez-kat).
Zinetika entzimatikoa
Entzimek katalizatutako erreakzio kimikoen abiadura eta sistemaren parametroak aldatzerakoan gertatzen diren abiaduraren aldaketak ikertzen ditu zinetika entzimatikoak. Katalizatu gabeko eta entzima batek katalizatutako erreakzioek substratu- eta produktu-kantitate bera erabili eta sortuko dute, eta oreka kimikoa berdina izango da. Baina entzimak katalizatutako erreakzioak, katalizatu gabekoak ez bezala, ase egiten dira. Hurrengo irudian, erreakzio kimikoaren abiadura (V) substratuaren kontzentrazioarekiko ([S]) irudikatu da. Ezkerreko grafikoan ikus daitekeenez, substratuaren kontzentrazio baxuetan, kontzentrazioa igo ahala, erreakzioaren abiadura linealki igoko da, substratu berriak gune katalitiko libreak aurkituko baititu. Baina substratuaren kontzentrazio jakin batetik gora, entzimen gune katalitiko guztiak beteta egongo dira, abiaduraren igoera geldotuz joango da, eta momentu batetik aurrera erreakzioaren abiadura ez da igoko; puntu horretan, erreakzioaren abiadura, abiadura maximoa (Vm) izango da.
Substratuaren kontzentrazioaren eta erreakzioaren abiaduraren arteko erlazio aljebraikoa Leonor Michaelis eta Maud Menten ikertzaileek proposatu zuten 1913. urtean, eta Michaelis-Menten ekuazio deritzo.
Michaelis-Menten konstante (Km) deritzo erreakzioaren abiadura Vm-aren erdia deneko substratuaren kontzentrazioari (ikus hurrengo irudiaren eskumako atala).
Erreakzio entzimatikoaren abiaduraren (V) eta substratuaren kontzentrazioaren ([S]) arteko erlazioa. Erreakzioak lor dezakeen abiadura maximoa da Vm. Eskumako grafikoan, Michaelis-Menten konstanteari dagokion erreakzioaren abiadura eta substratuaren kontzentrazioa adierazi dira
Km-a entzima bakoitzaren ezaugarri propioa da, eta entzimak substratuarekiko duen afinitatearen adierazlea. Km baxuak, afinitate altua adierazten du, hau da, substratu-kantitate txikiarekin erreakzioaren abiadura abiadura maximoaren erdira helduko da. Km altu batek, ordea, substratuarekiko afinitate baxua adierazten du, abiadura maximoaren erdira heltzeko substratu-kantitate handia behar delako.
Dena dela, entzima guztiek ez dute Michaelis-Menten zinetika aurkezten. Gune katalitiko anitz dituzten eta substratu molekula bat baino gehiago lot dezaketen entzimen kasuan, substratuaren molekula baten loturak eragina du hurrengoaren loturan. Ezaugarri horri kooperatibotasun deritzo. Kooperatibotasun positiboa substratuaren molekula bat lotzean hurrengoaren lotura faboratzen denean gertatzen da; kooperatibotasun negatiboan, ordea, substratuaren molekula baten loturak hurrengoaren lotura desfaboratzen du.
Inhibizio entzimatikoa
Inhibitzaile entzimatikoak erreakzio kimikoak geldotuz edo geldituz katalisia oztopatzen duten agente molekularrak dira. Inhibitzaile entzimatikoak agente farmazeutikoen artean erabilienetarikoak dira, entzimek prozesu zelular guztietan parte hartzen baitute. Azido azetilsalizilikoak (aspirinak), adibidez, COX-1 eta COX-2 entzimak inhibitzen ditu. COX-1 eta COX-2 entzimek hanturaren mezularia den prostaglandina sortzen dute; beraz, aspirinak prostaglandinaren sintesia galaraziz ezabatzen du mina. Inhibitzailearen eta entzimaren arteko elkarrekintza-motaren arabera, inhibizioa itzulgarria edo itzulezina izan daiteke.
Inhibizio itzulgarria
Inhibizio itzulgarrien ereduak. (a) inhibizio konpetitiboa, (b) inhibizio ez-konpetitiboa eta (c) inhibizio mistoa. E zirkulu urdinak entzima irudikatzen du, eta S-k eta I-k, substratua eta inhibitzailea, hurrenez hurren
Inhibitzaile itzulgarriak entzimei modu ez-kobalentean lotzen zaizkie.
-
Inhibizio konpetitiboa. Inhibitzailea eta substratua ezin zaizkio entzimari momentu berean lotu, inhibitzailea entzimaren gune aktiboari lotzen baitzaio. Inhibitzaile konpetitiboek normalean substratuaren egituraren antza dute. Inhibitzailearen lotura itzulgarria denez, substratuaren kantitatea handituz, inhibitzailearen efektua hein batean ekidin daiteke, entzima-inhibitzaile (EI) konplexua sortzeko probabilitatea baxuagoa izango delako.
-
Inhibizio ez-konpetitiboa. Inhibitzailea ez da entzimaren gune aktiboan kokatzen, eta entzima-substratu (ES) konplexuari bakarrik lotzen zaio. Kasu honetan, ez dago substratu eta inhibitzailearen arteko konpetentziarik; beraz, substratuaren kontzentrazioa igotzeak ez du galarazten inhibitzailearen efektua, eta erreakzioak ez du dagokion Vm-a lortuko.
-
Inhibizio mistoa. Inhibitzailea gune aktibotik kanpo kokatzen da, baina kasu honetan entzima askeari (E) zein entzima-substratu (ES) konplexuari lot dakioke. Inhibitzaile mistoek eragina dute erreakzioaren Vm-an eta entzimaren Km-an.
Inhibizio itzulezina
Inhibitzaile hauek normalean entzimarekin elkarrekintza kobalenteak eratzen dituzte, eta kasu askotan katalisirako beharrezkoak diren talde funtzionalak suntsitzen dituzte. Inhibizio itzulezinaren kasu berezi bat inhibizio suizida da, zeinetan entzimak berak inhibitzailea eraldatu egiten duen eta eraldatutako inhibitzailea den inhibizio itzulezina sortuko duen molekula.
Aktibitate entzimatikoaren kontrola
Entzimek prozesu metaboliko guztietan parte hartzen duten heinean, euren aktibitatearen kontrolak oso zehatza izan behar du, eta beharrezkoak diren leku eta momentuan besterik ez dute aktibo egon behar. Zeluletan entzimen aktibitatea kontrolatzeko, bost modu nagusi daude:
-
Ekoizpena: entzimen geneen transkripzio eta itzulpenaren kontrola. Ekoizpena zelularen inguruan gertatzen diren aldaketen arabera handitu eta txikitu daiteke. Bakterioek, antibiotikoen presentzian, antibiotikoak hidrolizatzen dituzten entzimak ekoizten dituzte adibidez.
-
Konpartimentazioa: entzimak zelularen organulu desberdinetan lokalizatuz, organulu horietan soilik gertatuko da erreakzio entzimatikoa.
-
Inhibitzaile eta aktibatzaileak. Kasu askotan, bide metaboliko baten azken produktua bidearen lehenengo entzimaren inhibitzailea izan daiteke. Inhibizio-mekanismo horri berrelikadura negatibo (negative feedback) deritzo. Era honetan, zelulak eskariaren arabera kontrola dezake metabolitoen ekoizpena, eta, kontrola hasierako puntuan gertatzen denez, ez dira produktuak gehiegizko kantitatean ekoizten, eta energia aurrezten da.
-
Aldaketa kobalenteak. Kate polipeptidikoaren hainbat aldaketa kobalentek, fosforilazioa kasu, entzimaren aktibitatea alda dezakete. Entzima batzuk proentzima edo zimogeno izeneko aitzindari ez-aktibo moduan sintetizatzen dira, eta aitzindari horien parte baten ebaketak entzimaren aktibazioa dakar.
-
Ingurunearen araberako aktibazioa. Kasu batzuetan, entzimak pH-aren arabera aktibatu egiten dira. Beraz, ingurune egokian kokatu arte ez dute euren erreakzioa burutuko.
Funtzio biologikoak eta aplikazioak
Entzimak prozesu biokimiko guztien muinean agertzen dira. Elikagaiak digeritzeko, energia kimikoa kontzentratu eta eraldatzeko eta aitzindari sinpleenetatik makromolekula biologikoak sortzeko behar diren ehunka erreakzio-sekuentzia katalizatzen dituzte.
Entzimek prozesu biologiko guztietan parte hartzen duten heinean, euren funtzionamendu okerrak gaixotasunak sor ditzake. Adibide ezagunenetarikoa fenilzetonuriarena da. Gaixotasun horretan, fenilalanina hidrolasaren (fenilalaninaren degradazio-bidean parte hartzen duen lehen entzimaren) mutazioak fenilalanina eta horren produktu erlazionatuen metaketa dakar, eta metaketa horrek ondorio kaltegarriak ditu gizakiarentzat.
Entzimak ekoizpen industrial askotan erabiliak dira, batez ere erreakzio oso espezifikoak katalizatu behar diren kasuetan. Dena dela, askotan, nahiz eta erreakzio industrialak katalizatzeko gai izan, entzimak ezegonkorrak dira erreakzio horiek industrialki ekoizten diren baldintzetan (tenperatua altuak, muturreko pH-ak…), eta ezin dira erabili. Entzimen edo proteinen ingeniaritza sail garrantzitsua da alor bioteknologikoan; izan ere, entzimek eraldatuz ezaugarri berriak lor ditzakete.