azufre
- 1. Kim.
Zenbaki atomikoa 16 duen elementu kimikoa. Solido ez-metalikoa da, horia eta usain eta zaporerik gabea. Beroaren eta elektrizitatearen eroale txarra da. Sufrea oso zabalduta dago lurrazalean, gehienetan sulfuro edo sulfato eran. Koloratzaileak, bolbora, pospoloak, ongarriak eta abar fabrikatzeko, fungizida gisa eta kautxua bulkanizatzeko erabiltzen da. Erregai fosilen osagaia da, eta horiek erretzean atmosferara iragaten diren oxidoak ematen ditu.

- 1. Kim.
- Zenbaki atomikoa 16 duen elementu kimikoa. Solido ez-metalikoa da, horia eta usain eta zaporerik gabea. Beroaren eta elektrizitatearen eroale txarra da. Sufrea oso zabalduta dago lurrazalean, gehienetan sulfuro edo sulfato eran. Koloratzaileak, bolbora, pospoloak, ongarriak eta abar fabrikatzeko, fungizida gisa eta kautxua bulkanizatzeko erabiltzen da. Erregai fosilen osagaia da, eta horiek erretzean atmosferara iragaten diren oxidoak ematen ditu.
Sufrea Edit
Egilea: Aintzane Goñi
Taula periodikoan, sufrea 3 periodoan eta 16 taldean kokatuta dago, kalkogenoen taldean. Taldeburuarekin, oxigenoarekin, antzekotasun kimikoak ditu, eta baita desberdintasunak ere: sufrea tamainaz handiagoa da, ez oxigenoa bezain elektronegatiboa, eta Lewisen egituretan loturak osatzeko zortzi elektroi baino gehiago parteka ditzake.
Propietate fisiko eta kimikoak
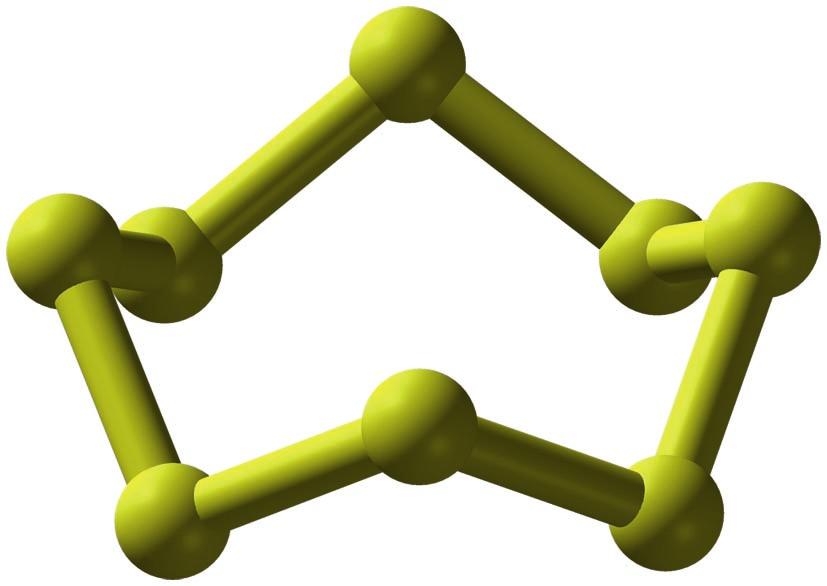
Sufreak alotropo asko ditu. Naturan, elementua S8 eraztunez osatutako solido ortorronbiko horia da, baina tenperatura igo ahala zenbait aldaketa gertatzen dira. 95 °C-tik gora, S8 molekulen paketatze-modua aldatu egiten da, eta solido polimorfo monoklinikoa sortzen da. Fusio-tenperaturaren gainetik oktasufre bilakatzen da, hots, biskositate baxuko likido hori eta garden. 159 °C-tik gora, likidoa ilundu, eta biskositatea modu ikusgarrian areagotzen da. S8 eraztunak zabaldu eta elkartu egiten dira, eta Sn kate luzeak osatzen dituzte. Polimero honetan, 20.000 sufre-atomo elkar daitezke. Irakite-puntuaren inguruan, kateak apurtu, eta S8 eraztunak berreskuratu egiten dira; hala, lurrun berdea sortzen da. Azkenik, 700 °C baino tenperatura altuagoetan, gasak kolore morea hartzen du, eta S2-z osatuta egoten da, hau da, dioxigenoaren antzeko molekulez. Alotropo horiez guztiez gain, beste eraztun batzuk ere lortu izan dira sintetikoki, haien artean egonkorrenak: S6 eta S12.
Sufre naturala (S8-zko kristal ortorronbikoak)
Sufrearen S8 forma alotropikoa
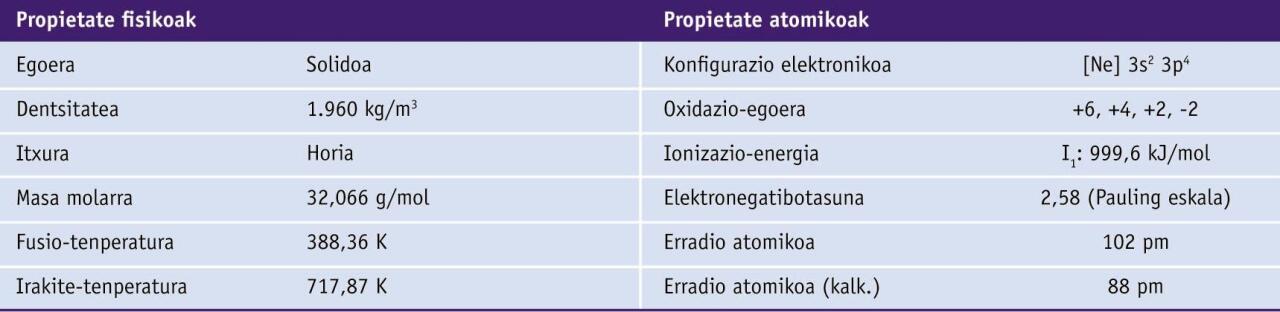
Sufrearen zenbait propietate
Sufrearen oxidazio-egoera nagusiak hauek dira: +6, +4, +2, 0 eta -2
Ugaritasuna eta produkzioa
Elementu ugaria da lurrazalean, bai S8 eran, bai hainbat konposatuetan. Sulfuro moduan mineral hauetan aurki daiteke: zinabrioa (HgS), galena (PbS), pirita (FeS2), esfalerita (ZnS)… Eta modu oxidatuan igeltsua (CaSO4 ·2H2O) eta antzeko sulfatoak osatzen ditu. Bestalde, ikatz, petrolio eta gas naturalaren konposatu organikoetan ere azaltzen da sufrea.
Erauzten den sufrearen ia % 90 azido sulfurikoa (H2SO4) sortzeko erabiltzen da. Hala ere, elementuak egoera solidoan ere aplikazioak ditu, hala nola kautxuaren bulkanizazioan, fungizida moduan eta abar.
Konposatu nagusiak
Sufrearen hamaika oxido ezagunak izan arren, nagusiak SO2 eta SO3 dira. Bi konposatu horiek bitarteko dira azido sulfurikoaren sintesian. Instalazio termikoek, zenbait industriek eta ibilgailuek erregai fosilak erretzean, SO2-aren kantitate handiak isurtzen dituzte atmosferara. Gas horren emisioa arazo larria da ingurugirorako. Atmosferan, sufre dioxidoa SO3-ra oxidatzen da, eta, ur-lurrunarekin erreakzionatuz, azido sulfurikoaren lainoa sortzen du, euri azidoaren osagaia, hain zuzen ere. Antzeko prozesua erabiltzen da industrian H2SO4-aren ekoizpenerako. Munduan gehien produzitzen diren gai kimikoen zerrendan, lehenengo postuan ageri da azido sulfurikoa. Produkzio horren zati nagusia ongarriak sortzeko erabiltzen da. Beste erabilera batzuk hauek dira: metalgintza, petrolioaren finketa, TiO2 pigmentu zuriaren ekoizpena, ibilgailuen bateriak eta abar.
Azido sulfurikoa azido sendoa da. Egoera diluituan, gai da baseak neutralizatzeko, metalak oxidatzeko edo karbonatoak disolbatzeko. Egoera kontzentratuan, urarekiko afinitate handia du, sakarosa bezalako hidrokarburoetatik oxigenoa eta hidrogenoa H2O-aren proportzioetan hartzen ditu, eta C puruaren hondakina uzten du:
H2SO4 (kontz.)
C12H22O11 (s) →→→→→ 12 C(s) + 11 H2O (l)
Beraz, kontuz maneiatu behar da, erredura larriak eragiten baititu.
Sulfato- eta sulfito-gatzek aplikazio asko dituzte: kaltzio sulfatoa, igeltsua, eraikuntzan erabiltzen da; aluminio sulfatoa, ur tratamenduetan; kobre(II) sulfatoa, fungizidetan, algizidetan, bainu elektrolitikoetan… Bestalde, papergintzan, garrantzitsuak dira sulfitoak, zelulosa-zuntzak askatzen dituztelako. Gainera, argazkigintzan, erreduzitzaileak dira, galdaretako uretan disolbatutako O2 gasa eliminatzeko gai dira eta abar.
Azido sulfhidrikoa (H2S) oso toxikoa da, zianuroa baino arriskutsuagoa. Gas naturala da, landareen usteltze-prozesuetan bakterio anaerobioek sortzen dutena. Kolorgea izan arren, arrautza ustelaren pareko usain bereziagatik berehala igartzen da inguruan dagoela.