hydrogen
- 1. Kim.
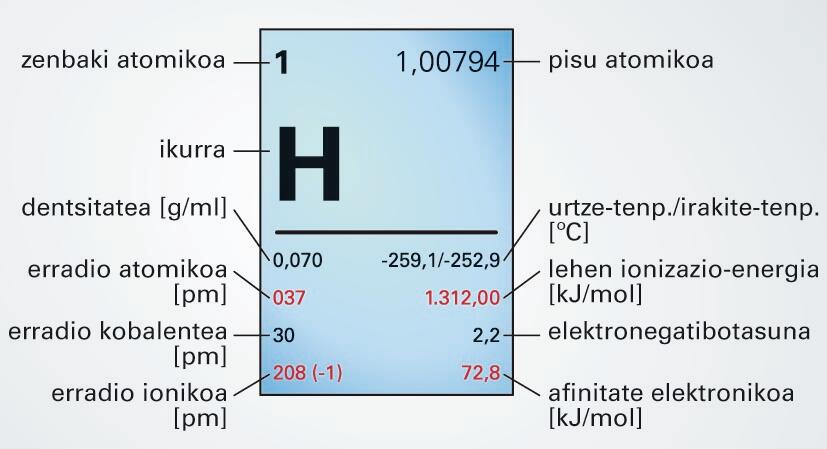
Zenbaki atomikoa 1 eta pisu atomikoa 1,0079 duen elementu kimikoa. Elementurik sinpleena da. Oso gas arina da, kolore eta usainik gabea. −253 °C-an likidotu eta −259 °C-an solidotzen da. Ez-metal eta metal gehienekin konbinatzen da, hidrazido eta hidruroak osatuz hurrenez hurren. Oso erabilia da industrian, hidrogenazio-erreakzioetarako nagusiki. Hidrogeno likidoa erregai moduan erabiltzen da astronautikan. Hidrogenoaren berotze-ahalmena 143 MJ/kg ingurukoa da.
- 1. Kim.
- Zenbaki atomikoa 1 eta pisu atomikoa 1,0079 duen elementu kimikoa. Elementurik sinpleena da. Oso gas arina da, kolore eta usainik gabea. −253 °C-an likidotu eta −259 °C-an solidotzen da. Ez-metal eta metal gehienekin konbinatzen da, hidrazido eta hidruroak osatuz hurrenez hurren. Oso erabilia da industrian, hidrogenazio-erreakzioetarako nagusiki. Hidrogeno likidoa erregai moduan erabiltzen da astronautikan. Hidrogenoaren berotze-ahalmena 143 MJ/kg ingurukoa da.
Hidrogenoa Edit
Egilea: Maite Insausti
Hidrogenoa ezagutzen den elementurik sinpleena da, bere zenbaki atomikoa 1 baita. Izena hydros (“ura”) eta gen (“sortu”) hitz grekoetatik datorkigu. Unibertsoko elementurik ugariena da (% 75), izarrak beren ziklo nagusian plasma-egoeran dagoen hidrogenoz osaturik baitaude. Lurreko gainazalean, berriz, hirugarren elementua da, eta ur modura edo karbonoarekin konbinaturik ageri da.
Propietateak
Tenperatura- eta presio-baldintza normaletan, gas diatomikoa da (H2), kolorgea, usaingabea, ez-metalikoa, zaporegabea eta sukoia. Hidrogeno-atomoaren konfigurazio elektronikoa 1s1 da. Alde batetik, metal alkalinoen antzeko joerak erakusten ditu, H+ katioia oxidazioz lortu baitaiteke (ur-disoluzioan H3O+ modu hidratatuan agertzen dena), baina ez da metala. Bestalde, halogenoen antza duen arren, hidruro alkalinoetan H- anioia (He-arekiko isoelektronikoa) eratzen du, eta ez da halogenoak bezain erreaktiboa. Hori dela eta, taula periodikoan bakarrik sailkatzen da, eta ez da talde batean kokatzen. Molekuletan, hidrogeno-loturak eratzeko gai den espezie bakarra da.
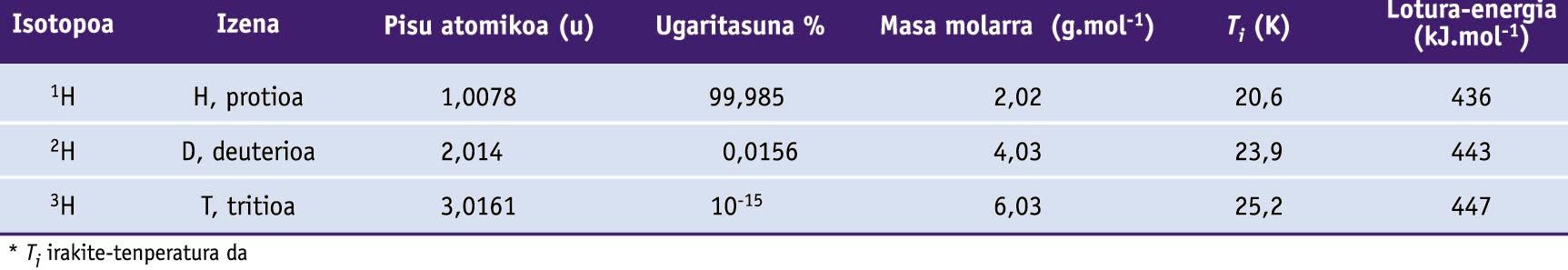
Hidrogeno-atomoak hiru isotopo ditu, hau da, protioa, deuterioa eta tritioa, zeinen propietateak beheko taulan ageri diren. Hidrogenoaren isotopoek diferentzia nabarmenagoak erakusten dituzte beren propietate fisiko eta kimikoetan beste elementuen isotopoek baino, neutroi bat gehitzeak oso eragin handia baitu hidrogenoaren pisu txikian.
Hidrogenoaren zenbait propietate
Hidrogeno gasa zinetikoki ez da oso erreaktiboa, H-H lotura sendoa delako (ΔHdis = 435,99 kJ/mol); beraz, erreakzionatzeko, energia asko eman behar zaio. Hidrogeno eta oxigenoaren arteko kate-erreakzio adarkatua txinpartaren eraginez hasten da, eta bortizki erreakzionatzen du; horren ondorioz, bero handia askatzen du (283 kJ.mol-1).
Lorpena
Laborategian, hidrogenoa uraren elektrolisiaren bidez edo azido diluitu eta metalen arteko erreakzioen bidez lor daiteke.
Hidrogenoa lortzea oso garrantzitsua da industria mailan, baina, bere pisu arina dela eta, hidrogenoa gordetzeak sistema oso bereziak eskatzen ditu. Gehienetan, hidrogenoa behar duten industriek instalazioan bertan ekoizten dute. Horretarako, gas naturaletik edo petroliotik lortutako hidrokarburoek (batez ere propanoa) ur-lurrunarekin erreakzionatzen dute, eta hidrogeno gasa askatzen da (1, 2). Horrez gain, ur-lurruna gori dagoen koke eta burdinatik zehar pasaraztean lor daiteke (3).
| CH4 (g) + H2O (g) CO (g) + 3H2 (g) ΔH º = 206 kJ | (1) |
| CO (g) + H2O (g) CO2 (g) + H2 (g) ΔH º = -41,2 kJ | (2) |
| C (s) + H2O (g) CO (g) + H2 (g) ΔH º = 130 kJ | (3) |
Aplikazioak
Hidrogenoaren aplikazioak ugariak dira, eta garrantzitsuenetako bat amoniakoa prestatzeko erabiltzen den Haber-Bosch prozesua da. Beste aplikazio bat petrolioaren finketa da, non prozesu batzuetan hidrogenoa ekoizten den eta beste batzuetan kontsumitzen den. Elikagaien industrian, zenbait koipe hidrogenatu egin behar dira jan aurretik. Koipeek lotura bikoitz gehiegi dutenean airean oxida daitezke, eta zapore txarra duten beste produktu batzuk sortzen dituzte. Produktu horiek ager ez daitezen, hidrogenoa elikagaien hidrokarburoak asetzeko erabiltzen da, Ni/Pt katalizatzaileetatik pasaraziz. Hidrogenazio-erreakzioak ere erabiltzen dira landare-olioak gantz solido bihurtzeko.
Hidrogenoa erregai modura
Erregai fosilen agortzeak hidrogenoa energia-iturri alternatibo bihur dezake, zeren hidrogenoa energia metatzeko, garraiatzeko eta erabiltzeko baliabidea izan baitaiteke. Energia lortzeko, errekuntzaren bidez egin daiteke (H2-aren eta O2-aren arteko erreakzio exotermikoa espazio-anezkaren propultsioan erabiltzen da) edo metodo elektrokimikoak erabiliz erregai-zeluletan. Bateria horietan, uraren elektrolisiaren alderantzizko prozesua egiten da, hots, hidrogenoaren errekuntzaz gain, energia elektrikoa sor daiteke, eta etekina handiagoa (% 80koa) da. Hidrogenoa bai era gaseosoan bai era likidoan biltegiratzeko zailtasunak direla eta, metodo berriak bilatzen ari dira; hala nola hidrogeno gaseosoa metal edo aleazio batean disolbatuta egonda, beharrezkoa denean beroketaren bidez hidrogenoa aska daiteke. Modu horretan, etorkizunerako erregai-tanga ordezkatuko lukeen biltegi-sistema izan daiteke.