elektrolisi
- 1. Kim.
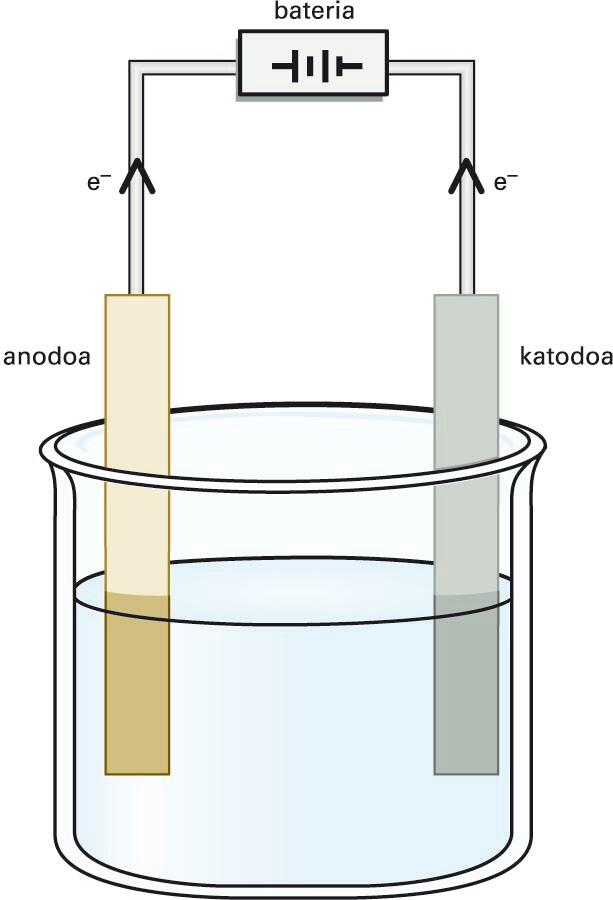
Korronte elektrikoa elektrolito baten disoluzioan zehar iragatean gertatzen den deskonposizio kimikoa. Deskonposizio horren ondorioz, ioiak eratzen dira. Ioiak dagokien elektrodorantz higitzen dira eta disoluzioak korronte elektrikoa eroaten du. Ioien eta elektrodoen artean oxidazio-erredukziozko erreakzioak gerta daitezke eta substantzia berriak era daitezke. Uraren elektrolisian, adibidez, uretatik korronte elektrikoa igarotzean oxigenoa eta hidrogenoa eratzen dira. Pila elektrokimikoaren funtsa elektrolisiaren alderantzizko prozesua da, hau da, elektrolitoa disoziaturik mantentzen da eta elektrodoak konektatuz korronte elektrikoa lortzen da.
- en electrolysis
- es electrólisis
- fr électrolyse
- 1. Kim.
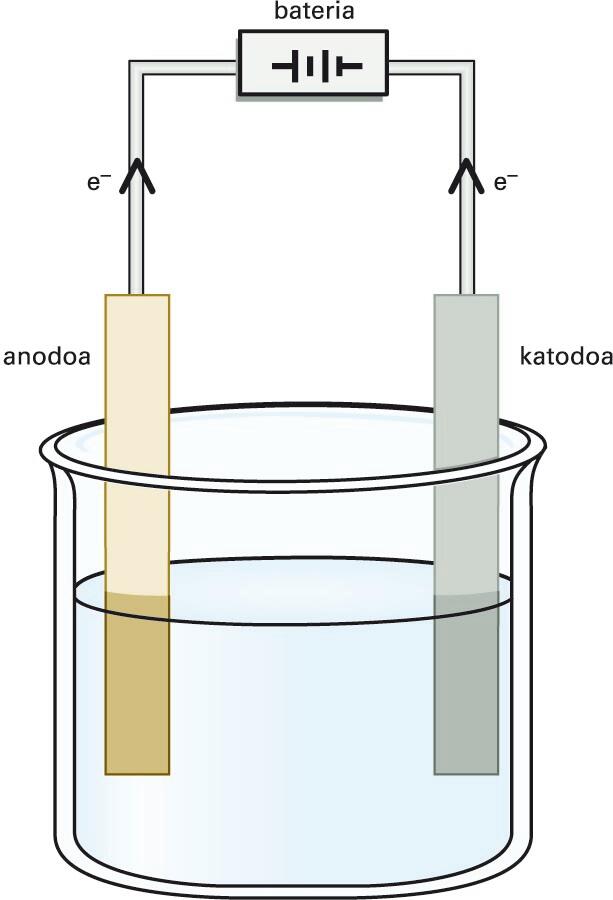
- Korronte elektrikoa elektrolito baten disoluzioan zehar iragatean gertatzen den deskonposizio kimikoa. Deskonposizio horren ondorioz, ioiak eratzen dira. Ioiak dagokien elektrodorantz higitzen dira eta disoluzioak korronte elektrikoa eroaten du. Ioien eta elektrodoen artean oxidazio-erredukziozko erreakzioak gerta daitezke eta substantzia berriak era daitezke. Uraren elektrolisian, adibidez, uretatik korronte elektrikoa igarotzean oxigenoa eta hidrogenoa eratzen dira. Pila elektrokimikoaren funtsa elektrolisiaren alderantzizko prozesua da, hau da, elektrolitoa disoziaturik mantentzen da eta elektrodoak konektatuz korronte elektrikoa lortzen da.
Elektrolisia Edit
Egilea: Fernando Mijangos
Elektrizitatearen bidez gauzatzen den lisia, hau da, apurketa da; zentzu zabalean, potentzial-diferentzia batek eragiten duen erreakzio kimikoa.
Korronte elektriko jarraitua sortzen duen iturri bateko katodoa (polo negatiboa) eta anodoa (polo positiboa) elektrolito batean (elektrolitoen disoluzioa, gatz urtua) murgilduta lortzen da.
Elektrolisi-prozesua
Hala, elektrolitoaren ioi positiboak katodorantz mugituko dira, eta ioi negatiboak, anodorantz. Horren kariaz, karga positiboa duten ioiei katioi deritze, eta negatiboei, anioi. Esate baterako, azido klorhidrikozko disoluzio batean gertatzen den elektrolisia honela bana daiteke:
Katodoan: H+ (aq)+ 1e- H2 (g)
Anodoan: Cl--1e- Cl2 (g)
Erreakzio osoa: HCl (aq) H2 (g) + Cl2 (g)
Elektrolisia oso prozedura baliagarria bilakatu da aluminio, sodio eta potasio metalak edota sodio hidroxidoa eta kloro gasa ekoizteko.
Elektrolisiari buruzko lehenengo ikerketak eta legeak Faradayk (1883) egin zituen, eta hari zor diogu elektrolisiaren bilakaera.
Pila galvaniko batean gertatzen den erredox prozesuari esker, energia elektrikoa sortzen da, eta energia elektrikoari esker, erreakzio kimiko batzuk aurrera eramaten dira; beraz, oso lotuta daude, eta biotan termodinamikaren ondorio guztiak aplikagarriak dira.
Gaur egun, uraren elektrolisia gauzatzen da hidrogeno-iturri gisa, eta prozesu hau gertatzen da: H2O H2 + ½ O2. Zentzugabekeria izango litzateke uraren hidrolisia gauzatzeko energia fosiletan oinarritzen den elektrizitatea erabiltzea, eta, gero, hidrogenoa erretzea energia lortu ahal izateko. Horregatik, gaur egun, uraren hidrolisia energia berriztagarrien bidez aurrera eraman nahi da, besteak beste berotegi-efektuaren kontra zerbait positiboa egin nahi denean.