amoniaco
- 1. Kim.
- sin. amoníaco
NH3 formulako konposatua. Gas kolorgea da, usain bortitzekoa eta begiak narritatzen dituena. Nitrogenoaren zikloko konposatu garrantzitsua da. Petroliotik, gas naturaletik edo sintesiz lortzen da. Industria kimikoan erabiltzen da, bereziki azido nitrikoa eta ongarriak ekoizteko.
- 2. Kim.
- sin. amoníaco
NH3 formulako konposatua. Gas kolorgea da, usain bortitzekoa eta begiak narritatzen dituena. Nitrogenoaren zikloko konposatu garrantzitsua da. Petroliotik, gas naturaletik edo sintesiz lortzen da. Industria kimikoan erabiltzen da, bereziki azido nitrikoa eta ongarriak ekoizteko.

- 1. Kim.
- NH3 formulako konposatua. Gas kolorgea da, usain bortitzekoa eta begiak narritatzen dituena. Nitrogenoaren zikloko konposatu garrantzitsua da. Petroliotik, gas naturaletik edo sintesiz lortzen da. Industria kimikoan erabiltzen da, bereziki azido nitrikoa eta ongarriak ekoizteko.
Amoniakoa Edit
Egilea: Maite Insausti
Naturan, lurrazaleko bakterioek, landareek eta deskonposatzen ari diren animaliek sortzen dute amoniakoa. Naturan ekoizten den amoniako-kantitate bera sintetizatzen da industrian, eta Txina, Amerikako Estatu Batuak, India eta Errusia dira ekoizle nagusiak. Nabaria da amoniakoak organismoen elikadurari egiten dion ekarpena, ezinbestekoa baita hainbat prozesu biologikotarako.
Propietateak
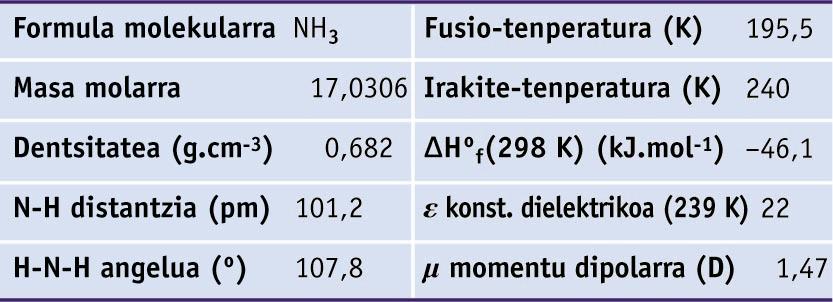
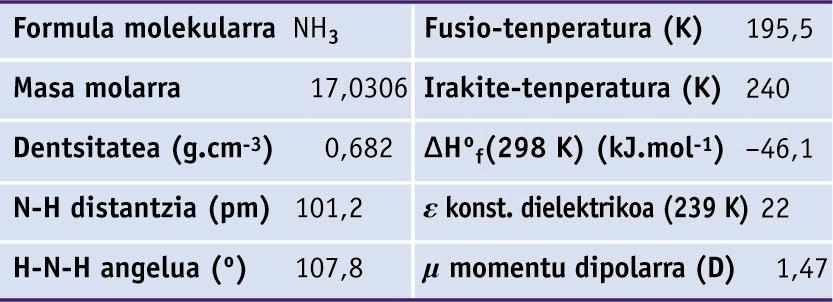
Amoniakoa, esan bezala, gas kolorgea eta toxikoa da, 20-50 ppm-ko kontzentrazioan hautematen dena, eta 100-200 ppm-an begietan eta sudur-hobietan narritadura sortzen duena. Amoniakoaren propietate fisiko eta molekular garrantzitsuenak ondoko taulan ageri dira.
Amoniakoaren zenbait propietate
Amoniakoa uretan disolbatzen da eta beroa askatzen du. Ur-disoluzioak basikoak dira, amonio hidroxidoa eratzen baita (1).
| NH3(aq) + H2O → NH4+ (aq) + OH-(aq) K = 1,81 × 105 mol·l1 | (1) |
Amoniako-gasak azido klorhidrikoarekin erreakziona dezake, eta amonio kloruroaren kea sortzen du. Amoniako-likidoa oso disolbatzaile ona da, ez-urezko disolbatzailerik erabiliena. Zenbait kasutan, erreakzio-ingurune egokia izan ohi da; lurruntze-bero altuaren ondorioz, maneiatzeko erraza da huts-ontzietan. Amoniako-likidoaren propietaterik garrantzitsuena metal alkalinoen disoluzio koloredunak eratzeko gaitasuna da. Disoluzio hauek eroale elektrikoak dira eta suszeptibilitate magnetikoa dute. Metalen kontzentrazio baxuko disoluzio urdina, kontzentrazioa handitzean, brontze eta metal koloredun bilakatzen da. Berezitasun hauen arrazoia metal alkalinoen ionizazioa da, M+ katioiak eta kuasiaskeak diren elektroiak eratzeko.
Lorpena
Amoniakoa laborategian lortzeko zenbait metodo daude: H2O-aren erasoa Li edo Mg nitruroetan, amoniozko gatzak baseekin berotzean (2) edo nitrato edo nitritoen erredukzioaren bidez, zinka edo aluminioarekin disoluzio alkalinoetan.
| NH4Cl (s) + Ca(OH)2 (s) → CaCl2 (s) + 2 H2O (l) + 2 NH3 (g) | (2) |
Industria-mailan, 1913. urtean martxan ipini zen Haber-Bosch prozesuaren bidez prestatu ohi da. Prozesu hau nitrogenoaren erredukzio katalitikoan hidrogenoarekin eta presiopean oinarritzen da (3) eta termodinamikoki egonkorra izan arren, aktibazio-energia altuegia dauka.
| N2 (g) + 3 H2 (g) 2 NH3(g) | (3) |
Gaur egungo metodoek hastapen berbera erabiltzen dute; ezberdintasunak hidrogenoaren jatorrian, katalizatzaileen eraginkortasunean edo produkzio-mailan datza. Erabiltzen den burdinazko katalizatzailea magnetitaren erreakzioaren bidez KOH-arekin lortzen da, eta aluminazko edo silizezko euskarri solido baten gainean barreiatzen da. Erreakzio katalitikoa burutu ondoren, sintetizatutako amoniako-gasa likidotzen da.
Erabilera
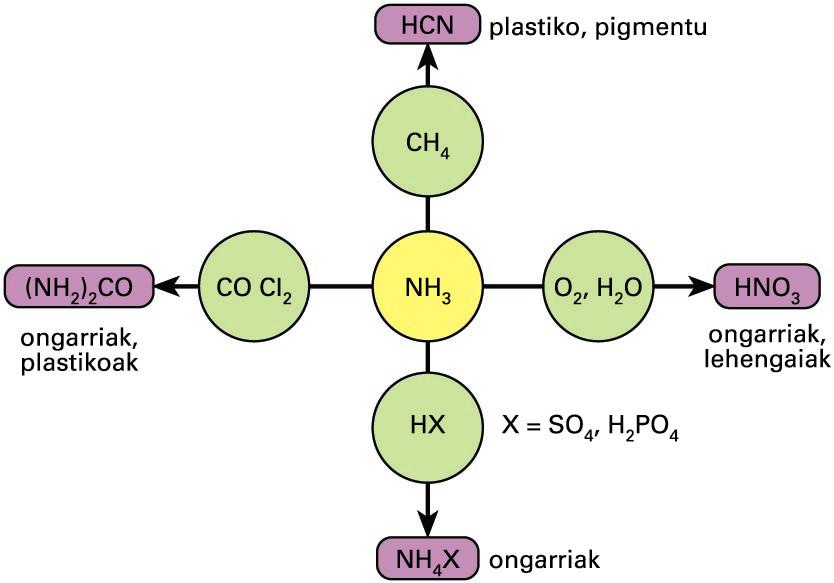
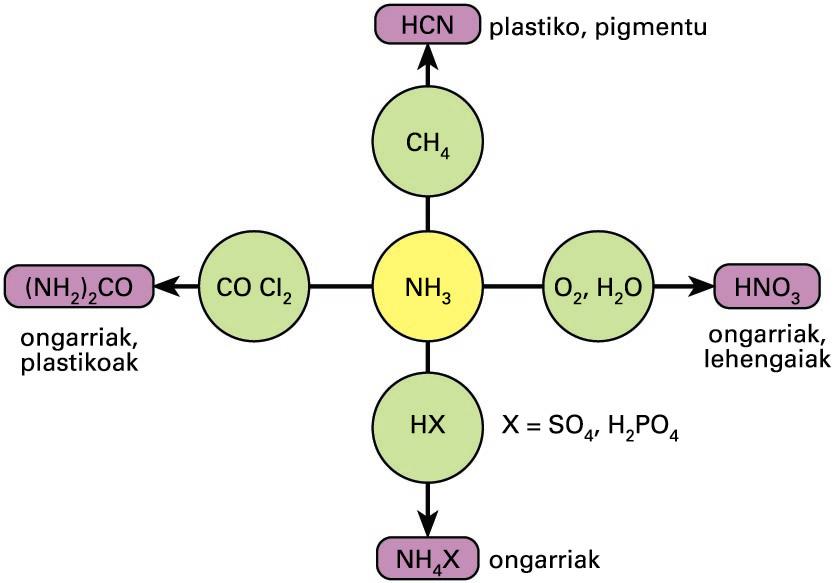
Ekoizten den amoniakoaren % 80 baino gehiago ongarriak prestatzeko edo, zuzenean, ongarri modura erabiltzen da. Lurreko hezetasunak amoniakoa nitrato bilakatzen du, baina maneiatzeko zaila denez, amoniozko gatzak erabili ohi dira eta amoniakoa gordetzearen arriskua txikiagotzen da. Gainerakoa ehunen, plastikoaren, lehergailuen, paperaren, elikagaien, edarien, garbitzeko produktuen, usain-gatzen edo beste produktu batzuen prestakuntzan erabiltzen da.
Amoniakoaren erabilera industrialak